2021-2022 учебный год
18.05
Тема урока: Проблемы безопасного использования веществ и химических реакций в повседневной жизни.
Познакомьтесь с теоретическим материалом. Запишите основную информацию по уроку в конспект.
В результате развития химии число химических соединений непрерывно растёт. Сейчас их насчитывается около 30 миллионов, и ежегодно открываются более 50 000 новых веществ. Подавляющее число этих веществ синтезируются только единожды и никогда не выходят за стены лабораторий, но тем не менее в своей жизни человек вольно или невольно сталкивается не менее чем со 100 000 различных химических веществ.
В процессе жизнедеятельности человеческого организма реализуется около миллиона различных химических процессов.
Познакомимся с основными группами практически важных химических веществ. Сведения о них будут излагаться в алфавитном порядке.
Антиоксидантами называют вещества, замедляющие или предотвращающие окислительные процессы, приводящие к различным нежелательным процессам: прогорканию пищевых жиров, осмолению топлив, старению полимеров, образованию шлама в технических маслах. Защита с помощью антиоксидантов особенно важна для продуктов, в молекулах которые есть ненасыщенные связи, например жиры или каучуки.
Антисептиками называют вещества, используемые для предохранения от разрушения различными микроорганизмами пищевых продуктов, текстильных изделий, кожи. Этими средствами пропитывают или покрывают защищаемый материал либо вводят их в его состав как биоцидные добавки. Из неорганических соединений в качестве антисептиков используют соли меди, цинка, а также многочисленные органические соединения.
Дезинфицирующими средствами называют химические вещества, используемые для уничтожения в окружающей среде возбудителей инфекционных болезней человека и животных.
Дезодорантами называют химические вещества, предназначенные для маскировки, ослабления или устранения неприятных запахов. Представляют собой, как правило, композиции органических веществ. Из неорганических веществ в качестве адсорбентов используют активированный уголь или силикагель.
По назначению различают дезодоранты воздуха и гигиенические. Дезодоранты воздуха служат для уничтожения стойких неприятных запахов в помещениях, одежды и т. д. Дезодоранты гигиенические (личные) служат для устранения запаха пота, освежения тела и полости рта, обработки внутренней поверхности обуви и ног с целью предотвращения их потливости и грибковых заболеваний.
Душистыми веществами называют органические соединения с характерным запахом, применяемые в производстве парфюмерных и косметических изделий, мыла, синтетических моющих средств, пищевых и других продуктов.
Зубными пастами называют средства для ухода за зубами и полостью рта, имеющие пастообразную консистенцию и содержащие в своём составе химически осажденный мел и различные целевые добавки, например обладающие антисептическим действием.
Керамикой называют неметаллические материалы и изделия, получаемые спеканием глин или порошков неорганических веществ. Различают фаянс — белый пористый керамический материал, покрытый прозрачной глазурью, и фарфор — белый спёкшийся керамический материал, прозрачный в тонком слое. По назначению различают хозяйственный и санитарный фаянс; декоративный и технический фарфор.
Консервантами называют химические вещества, которые применяют для предупреждения порчи продуктов микроорганизмами. Из неорганических веществ к ним относятся: SO2, сульфиты и гидросульфиты. Их используют для консервирования плодоовощных продуктов, полуфабрикатов и вин.
Лекарственными средствами называют вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики для лечения заболеваний и реабилитации. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты.
Моющими средствами называют технические препараты для удаления загрязнений с различных поверхностей, применяемые в водных растворах.
Пластмассами называют органические материалы, основой которых являются природные или синтетические высокомолекулярные соединения.
Средствами для окрашивания волос называют вещества и их комбинации, предназначенные для изменения цвета волос. Различают две группы веществ: поверхностно окрашивающие и постоянные. Поверхностно окрашивающие вещества легко удаляются при мытье, поскольку краситель наносится на поверхность волос, а химическое взаимодействие с живой тканью отсутствует. Постоянные красители вступают в окислительно-восстановительные процессы с живой тканью. В их состав входит аммиак, перекись водорода и другие вещества.
Удобрениями называют вещества или группы веществ, которые при внесении в почву создают условия для ускоренного роста растений.
Химическими средствами защиты растений называют группу химических и биологических соединений и препаратов, используемых для борьбы с вредителями и болезнями растений и животных, сорными растениями, вредителями сельскохозяйственной продукции, для регулирования роста растений, предуборочного удаления листьев и подсушивания растений.
11.05
Тема урока: Химические вещества как строительные и поделочные материалы
Продолжим тему прошлого урока. Предлагаю вам посмотреть видеофрагмент ССЫЛКА
Запишите краткую характеристику цемента (используйте дополнительные источники информации).
04.05
Тема урока: Человек в мире веществ, материалов и химических реакций
Познакомьтесь с теоретическим материалом
В процессе жизнедеятельности человеческого организма реализуется около миллиона различных химических процессов. В любой живой клетке человеческого организма могут протекать тысячи химических реакций. Понимание химических процессов, лежащих в основе болезни, помогает поиску способов её лечения. Основоположником медицинского направления в химии был швейцарский врач Т. Парацельс. Именно ему принадлежит высказывание, что цель химии состоит не в изготовлении золота и серебра, а в изготовлении лекарств. Парацельс впервые стал систематически применять для лечения больных неорганические вещества.
В результате естественного отбора основу живых организмов составляют только шесть элементов. Это углерод, водород, кислород, азот, фосфор и сера. Их общее групповое название — органогены. Человеческий организм на 97,4% состоит из органогенов.
Жизненно необходимыми (незаменимыми) элементами являются водород, кислород, азот, фосфор, сера, натрий, калий, магний, кальций, хлор, йод, марганец, медь, кобальт, железо, цинк, молибден и ванадий. Они постоянно содержатся в организме. Их дефицит приводит к нарушению нормальной жизнедеятельности человека.
Ниже приведены сведения о некоторых практически значимых и биологически активных неорганических веществах, которые носят прежде всего справочный характер. Сведения об элементах и их соединениях приведены в соответствии с их расположением в таблице Д.И. Менделеева.
Натрий и его соединения
Гидроксид натрия применяют в качестве реагента в химической промышленности, в производстве бумаги, искусственных волокон, для очистки нефти, масел и т. д.
В практике широко используют следующие соединения натрия.
Пероксид натрия Na2O2, используют для отбеливания различных материалов, для регенерации кислорода в дыхательных приборах изолирующего типа по реакции:
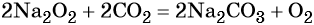
Карбонат и гидрокарбонат натрия Na2CO3 и NaHCO3 относятся к многотоннажным продуктам химической промышленности, применяются в различных отраслях химической, мыловаренной, бумажной, текстильной и пищевой промышленности.
Нитрат натрия NaNO3 применяют как удобрение, в производстве стекла, как консервант пищевых продуктов и т. д.
Хлорид натрия NaCl (поваренная соль) применяют в технике, пищевой промышленности и т. д.
Натрий относится к жизненно важным элементам. Он распределён по всему организму и является основным внеклеточным ионом. Ион натрия участвует в регуляции водного обмена и влияет на работу ферментов.
В медицине применяют растворы хлорида натрия различной концентрации для инъекций, промывания ран, компрессов и т. д. Кроме того, в медицине применяют питьевую соду NaHCO3 при различных заболеваниях, сопровождающихся повышенной кислотностью, а также бромид натрия как седативное средство и иодид натрия при лечении зоба.
Калий и его соединения
Гидроксид калия применяют для получения мыла, в щелочных аккумуляторах, как поглотитель кислых газов и т. д.
Около 90% добываемых солей калия потребляются в качестве удобрений.
Калий ускоряет процесс фотосинтеза и содействует накоплению углеводов в растениях. В качестве калийных удобрений используют природные (сырые) калийные соли и промышленные концентрированные удобрения.
Концентрированными удобрениями являются хлорид и сульфат калия.
Хлорат калия KClO3 (бертолетова соль) и нитрат калия KNO3 используют в пиротехнике.
Катион K+ является основным внутриклеточным катионом. Этот катион играет важную роль в нормальном функционировании сердца, проведении нервных импульсов, активизации ферментов.
В медицинской практике применяют хлорид калия при калиевом истощении, бромид калия KBr как седативное средство, а также некоторые другие соединения калия.
Магний и его соединения
Магний в основном используют для производства «сверхлёгких» сплавов. Одним из наиболее важных является сплав электрон, который применяют в ракетной технике и авиастроении. Кроме того, магний используют в металлотермии, при изготовлении осветительных и зажигательных ракет, снарядов и т. д.
Магний играет важную роль в жизнедеятельности живых организмов и человека. В медицинской практике используют оксид магния при избыточной кислотности, а также сульфат магния MgSO4 × 7H2O в качестве слабительного и желчегонного средства.
Кальций и его соединения
Гидроксид кальция Ca(OH)2 (известковое молоко, гашеная известь) — белое кристаллическое вещество, плохо растворимое в воде. Получают его из соответствующего оксида. Является сильным основанием. Применяют как вяжущий материал в строительстве, для раскисления почв, в производстве стекла, сахара и т. д.
Природные соединения кальция широко применяют в производстве вяжущих материалов. Вяжущими материалами называют порошкообразные вещества, образующие при смешении с водой пластичную массу, затвердевающую в твёрдое камневидное тело. Их широко используют для изготовления бетона, строительных деталей и конструкций, а также для сцепления отдельных элементов сооружений. К вяжущим веществам относятся цементы, гипсовые материалы, известь и др.
Кальций играет исключительно важную роль в жизнедеятельности человеческого организма. Катион Ca2+ присутствует в каждой клетке человеческого организма, а основная его масса сосредоточена в костной и зубной ткани в виде нерастворимого кристаллического минерала — гидроксилапатита Ca10(PO4)6(OH)2. Ионы кальция принимают активное участие в сокращении мышц, передаче нервных импульсов и т. д.
В медицинской практике широко применяют ряд препаратов, являющихся кальциевыми солями различных органических кислот: глутаминовой, молочной и т. д. Из используемых в медицине неорганических солей кальция наиболее известен жжёный гипс CaSO4 × ½H2O (гипсовые повязки при переломах), а также хлорид кальция.
Алюминий и его соединения
Алюминий широко применяют как конструкционный материал, основу для создания лёгких сплавов (например, дюралюминий; силумин). Сплавы алюминия используются в авиастроении, автомобилестроении и судостроении. Из алюминия изготавливают электрические провода, алюминиевую фольгу используют в пищевой промышленности.
Из солей алюминия отметим его сульфат Al2(SO4)3 и алюминиевые квасцы общей формулы MAl2(SO4)3 × 12H2O, где М = K, NH4, Na. Так, алюмо-калиевые квасцы KAl(SO4)2 × 12H2O используют как дубитель, протраву при крашении, для проклейки бумаги и т. д.
Биологическая роль алюминия выяснена недостаточно подробно. Известно, что алюминий влияет на развитие эпителиальной и соединительной ткани, ряд ферментативных процессов и т. д.
В медицинской практике применяют гидроксид алюминия и различные препараты на его основе в качестве обволакивающих, абсорбирующих и антацидных средств. Алюмо-калиевые квасцы применяют как кровоостанавливающее средство.
Углерод и его соединения
Их широко используют во всех отраслях промышленности. Так, алмаз применяют для обработки особо твердых материалов, при буровых работах. Кристаллы алмаза после огранки и шлифования называются бриллиантами и применяются для изготовления ювелирных изделий.
Графит используют для приготовления электродов, плавильных тиглей, в качестве замедлителя нейтронов в атомных реакторах, для изготовления карандашей, как смазочный материал и т. д.
Технические сорта графита: кокс, древесный уголь, животный уголь — сажу используют в металлургии, для изготовления красок, чёрной резины, в качестве адсорбентов и т. д.
Углерод является органогеном. На его основе построены все органические соединения. Он входит в состав тканей и клеток в форме белков, жиров, углеводов, витаминов и гормонов.
В медицинской практике при различных отравлениях применяют специально обработанный уголь животного или растительного происхождения, так называемый активированный уголь.
Кремний и его соединения
Их широко применяют в технике как основу полупроводниковых материалов, как легирующие добавки к сталям и т. д.
Карбид кремния SiC (карборунд) применяют как абразивный и огнеупорный материал, в радиотехнике и т. д.
Нитрид кремния Si3N4 используют в качестве химически стойкого и огнеупорного материала, в создании тугоплавких сплавов, в качестве высокотемпературного полупроводника.
Огромный научный интерес представляют кремнийорганические соединения.
Биологическая роль кремния выяснена недостаточно. Убедительных данных о заболеваниях, вызванных недостатком кремния, нет.
Вдыхание пыли, содержащей SiO2, приводит к силикозу.
В медицинской практике применяют карбид кремния SiC для шлифовки пломб и пластмассовых протезов.
Азот и его соединения
Нитраты широко используются в производстве легко воспламеняющихся и взрывчатых веществ. Так, черный порох имеет следующий состав: 68% KNO3, 15% S, 17% С.
Азотную кислоту широко используют в производстве взрывчатых веществ, искусственных волокон и пластических масс, для травления металлов, в ракетной технике.
Особую роль играют азотные удобрения, которые очень широко применяются в сельском хозяйстве. Из них отметим нитрат натрия NaNO3, нитрат калия KNO3, нитрат аммония NH4NO3, сульфат аммония (NH4)2SO4 и карбамид (мочевину) OC(NH2)2.
Азот является органогеном. Он входит в состав всех важнейших органических соединений. В медицинской практике применяют 10%-ный раствор NH3 как средство скорой помощи для возбуждения дыхания и выведения больных из обморочного состояния, хлорид аммония NH4Cl как диуретик, оксид азота (I) N2O (веселящий газ) при простых операциях, в стоматологической практике и т. д.
Многие оксиды азота в высоких концентрациях являются высокотоксичными соединениями.
Фосфор и его соединения
Ортофосфорную кислоту применяют как реагент в неорганическом и органическом синтезе, полупродукт для получения минеральных удобрений, как компонент антикоррозийных покрытий, в пищевой промышленности и т. д.
Особое значение имеют фосфорсодержащие минеральные удобрения. Фосфор является необходимым элементом для жизнедеятельности растений, улучшения качества почв.
Соли фосфорной кислоты входят в состав азотно-фосфорных и азотно-фосфорно-калийных удобрений. Из них отметим аммофос, представляющий смесь моно- и дифосфатов аммония NH4H2PO4 и (NH4)2HPO4, а также нитрофоску — смесь NH4H2PO4, (NH4)2HPO4, CaHPO4, NH4NO3, KNO3, KCl.
Фосфор относится к органогенам. Его соединения составляют основу скелета и зубов животных и человека. Фосфор входит в состав белков и нуклеиновых кислот. Сахара и жирные кислоты могут быть использованы клетками в качестве источника энергии только при предварительном фосфорилировании.
Огромный интерес представляют фосфорорганические соединения. Среди них найдены эффективные лекарственные препараты, химические средства защиты растений. Наиболее токсичные и эффективные боевые отравляющие вещества (зарин, зоман, VX) также являются фосфорорганическими соединениями. Химия фосфорорганических соединений представляет собой огромный самостоятельный раздел элементоорганической химии.
Из неорганических соединений фосфора в медицинской практике применяют фосфаты алюминия AlPO4 и цинка Zn3(PO4)2, которые входят в состав фосфат-цементов, применяемых в стоматологии в качестве пломбировочного материала.
Кислород и его соединения
Кислород является органогеном. Он входит в состав всех жизненно важных органических веществ: белков, жиров и углеводов.
Без кислорода невозможны многочисленные жизненно важные процессы: дыхание, окисление аминокислот, жиров, углеводов.
В медицинской практике кислород применяют для вдыхания при болезненных состояниях, сопровождающихся кислородной недостаточностью, например заболевания дыхательных путей, сердечно-сосудистой системы и др.
Озон используют для дезинфекции помещений, обеззараживания воздуха и очистки питьевой воды. Небольшие примеси озона в воздухе улучшают состояние человека, особенно легочных больных.
Сера и её соединения
Сульфат кальция CaSO4 существует в виде двух кристаллогидратов: гипса CaSO4 × 2H2O и алебастра 2CaSO4 × H2O, применяют в строительстве и медицине для изготовления шин, повязок и т. д.
Сульфаты меди и железа используют для борьбы с вредителями растений.
Сульфат цинка ZnSO4 × 7H2O используют в качестве протравы для крашения тканей.
Сера относится к органогенам. Она входит в состав белков, аминокислот, гормонов, витаминов.
В медицинской практике применяют осаждённую серу как противоглистное средство. Осаждённая сера входит в состав ряда мазей и присыпок при лечении кожных заболеваний. Сульфат натрия Na2SO4 × 10H2O (глауберова соль) используется в качестве слабительного. Реже в медицинской практике применяют и другие соединения серы.
Фтор и его соединения
Соли фтористоводородной кислоты — неорганические фториды широко применяются в различных областях техники, например для разделения изотопов урана, синтеза хладагентов и т. д.
Жидкий фтор и некоторые из его соединений применяют в качестве окислителей ракетного топлива.
Соединения фтора обладают разнообразной биологической активностью. Фтор относят к микроэлементам. Его недостаток приводит к заболеванию, называемому гипофторозом, и проявляется кариесом зубов. При избыточном поступлении фтора в организм возникают различные формы флюороза и ряд профессиональных заболеваний. Практически все неорганические фториды являются высокотоксичными соединениями.
В медицинской практике используют фторид натрия NaF в виде полосканий, а также как добавку к зубной пасте.
Хлор и его соединения
Важное значение имеют следующие соединения хлора:
- Хлорид натрия NaCl применяют для получения гидроксида натрия, соляной кислоты, хлора, карбоната натрия, в мыловаренной и пищевой промышленности.
- Хлорид калия KCl применяют как калийное удобрение, для получения гидроксида и солей калия.
- Хлорид магния MgCl2 применяют для получения магния, цементов, в виде водных растворов — как средство против обледенения.
- Хлорид кальция CaCl2 применяют для получения кальция, как осушающий агент, его водные растворы используют в качестве хладагентов, средства против обледенения.
- Хлорид серебра AgCl применяют в фотографии.
- Хлорид алюминия AlCl3 применяют как катализатор в органическом синтезе.
- Хлорид железа (III) FeCl3 применяют как коагулянт при очистке воды, протраву при крашении.
- Хлорид ртути (I) Hg2Cl2 применяют как катализатор органических реакций, антисептик.
- Хлорид ртути (II) Hg2Cl применяют как протраву для семян, как катализатор в органическом синтезе.
- Хлорат калия KClO3 применяют в производстве взрывчатых веществ, спичек, для получения кислорода в лабораторных условиях.
- Хлорат кальция Ca(ClO3)2 применяют как окислитель в пиротехнике, гербицид, дефолиант для хлопчатника.
Хлор и его соединения обладают высокой биологической активностью и играют в организме человека важную роль. Хлор относится к сильнодействующим ядовитым веществам. Во время Первой мировой войны его использовали как боевое отравляющее вещество.
Хлорид-ион активирует некоторые ферменты, участвует в поддержании осмотического давления. В медицинской практике при недостаточной кислотности желудочного сока применяют разведенную соляную кислоту.
Раствор хлорида натрия 0,9% (изотонический) применяют при кровопотерях, интоксикациях, для растворения различных лекарственных веществ.
Гипертонические растворы хлорида натрия (3, 5, 10% соответственно) применяют в виде компрессов при лечении гнойных ран.
Хлорид кальция CaCl2 × 6H2O широко применяют как кровоостанавливающее средство, при аллергических заболеваниях и т. д.
Бром и его соединения
Применяют бром как бромирующий агент в органическом синтезе, для изготовления красителей и т. д.
Биологическая роль соединений брома выяснена недостаточно. В прошлом препараты брома NaBr и KBr широко применялись в качестве успокаивающих и противосудорожных средств. В настоящее время ими пользуются реже, но своего значения они не потеряли.
Йод и его соединения
Йод широко применяют в аналитической химии, в промышленности — для рафинирования тугоплавких металлов, как реагент в синтезе лекарственных препаратов.
Йод относится к числу незаменимых биогенных элементов. В организме он находится в связанном состоянии — в виде некоторых гормонов. Пары йода ядовиты. Как избыток, так и недостаток йода в организме приводит к различным заболеваниям.
В медицинской практике используют спиртовой раствор йода как антисептическое средство, а также йодид калия KI.
Железо и его соединения
Важнейшей областью применения железа является получение чугуна, стали и специальных сплавов.
Из солей железа в промышленности применяют железный купорос FeSO4 × 7H2O для приготовления минеральных красок, борьбы с вредителями растений; хлорид железа (III) FeCl3 как протраву при крашении ткани, коагулянт при очистке воды; сульфат железа (III) Fe2(SO4)3 × 9H2O как коагулянт и для травления металлов.
Железо является важнейшим биогенным элементом. Его общее содержание в организме человека составляет около 5 г. Большая часть железа содержится в гемоглобине крови, который обратимо связывает кислород и переносит его от легких к тканям. Кроме того, железо входит в состав ряда ферментов. Как избыток, так и недостаток железа в организме приводит к различным заболеваниям. Одним из самых серьёзных заболеваний, вызванных недостатком железа в организме, является гипохромная анемия. В медицинской практике используют более десяти различных препаратов железа, основу которых составляют FeCl3 × 4H2O, FeSO4 × 7H2O, лактат железа (II) [H3C–CH(OH)–COO]2Fe × 3H2O.
Выполните письменно следующие тестовые задания:
Тренировочные задания
1. Верны ли следующие суждения о правилах безопасного обращения с веществами в быту?
А. При работе с жидкими чистящими препаратами для ванн и раковин рекомендуется использовать резиновые перчатки.
Б. Растительное масло следует хранить вместе с препаратами бытовой химии.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2. Верны ли следующие суждения о способах хранения веществ?
А. Кисломолочные продукты в открытой упаковке можно хранить длительное время.
Б. Витамин С выдерживает длительное кипячение в воде.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Верны ли следующие суждения о приготовлении растворов и правилах безопасного обращения с веществами?
А. Готовить растворы кислот (уксусной, лимонной и др.) в домашних условиях в алюминиевой посуде не рекомендуется.
Б. При попадании раствора аккумуляторной серной кислоты на кожу рук следует промыть обожжённый участок водой и обработать раствором борной кислоты.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
4. Верны ли суждения о правилах применения и опасности для здоровья препаратов бытовой химии?
А. Стиральные порошки можно использовать для мытья посуды.
Б. Пары хлора полезны для здоровья.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Верны ли суждения о правилах применения и хранения препаратов бытовой химии?
А. Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных.
Б. Органические растворители являются негорючими жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
6. Верны ли следующие суждения о видах смесей и препаратах бытовой химии?
А. Смесь растительного масла и воды является гомогенной смесью.
Б. Железо является жизненно важным элементом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Верны ли следующие суждения о способах приготовления растворов в химической лаборатории и о значении химических процессов в быту?
А. Для приготовления растворов кислот в химической лаборатории не следует брать алюминиевую посуду.
Б. Углекислый газ поддерживает горение.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
8. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории и c препаратами бытовой химии?
А. В лаборатории наличие кислоты в растворе определяют на вкус.
Б. Оксиды серы и азота являются загрязнителями атмосферного воздуха.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории и хранения веществ в быту?
А. При попадании раствора кислоты на кожу её следует промыть водой и обработать раствором питьевой соды.
Б. В состав всех органических веществ входит углерод.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
10. Верны ли следующие суждения о способах хранения веществ?
А. Промышленные консервы содержат в своём составе консерванты.
Б. Минеральные удобрения можно употреблять в пищу.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
11. Верны ли следующие суждения о способах приготовления растворов в химической лаборатории и быту?
А. Для приготовления раствора кислоты следует к концентрированной кислоте приливать воду.
Б. Раствор медного купороса, используемый для опрыскивания садовых деревьев, не следует хранить в оцинкованном ведре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
12. Верны ли суждения о правилах применения и опасности для здоровья препаратов бытовой химии?
А. Стиральные порошки нельзя использовать для мытья посуды.
Б. Перекись водорода не повреждает волосы при контакте.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Верны ли суждения о правилах применения и хранения препаратов бытовой химии?
А. Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных.
Б. Органические растворители являются горючими жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
14. Верны ли следующие суждения о влиянии химических веществ на окружающую природную среду и составе средств гигиены?
А. Промышленные выбросы оксидов азота и серы вызывают кислотные дожди.
Б. Зубная паста, содержащая ионы железа, способствует укреплению зубной эмали.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Верны ли следующие суждения о биологической роли химического элемента и об использовании химических реакций для оказания человеку первой помощи?
А. Без кислорода жизнь человека невозможна.
Б. Раствор питьевой соды используется для обработки участка кожи, на который попала кислота.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
16. Верны ли следующие суждения о смесях и составе моющих средств?
А. Раствор аммиака в воде (нашатырный спирт) — это гомогенная смесь.
Б. В состав мыла входит стеарат натрия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Верны ли следующие суждения о химическом элементе и значении средств гигиены?
А. Алюминий является основным металлом в авиастроении.
Б. Зубная паста, содержащая ионы фтора, способствует укреплению зубной эмали.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Верны ли следующие суждения о химическом элементе и препаратах бытовой химии?
А. Соединения кальция являются основой бетона.
Б. Отбеливающие препараты бытовой химии безопасны для человека и животных.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Верны ли суждения о химическом загрязнении окружающей среды и его последствиях?
А. Повышенное содержание в замкнутом пространстве оксида углерода (II) не является угрожающим фактором для здоровья человека.
Б. Производство чугуна и стали является источником загрязнения атмосферы.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
20. Верны ли суждения о химическом загрязнении окружающей среды и его последствиях?
А. Повышенное содержание в атмосфере оксидов азота оказывает благотворное влияние на здоровье человека.
Б. Наличие неорганических щелочей в промышленных стоках положительно влияет на жизнедеятельность рыб в водоёмах.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19.04
Тема урока: Соединения железа(II) и железа(III).
Здравствуйте ребята. Запишите в тетради тему урока. Проработайте теоретический материал по теме урока.
Соединения железа(
Соли железа(
Оксид и гидроксид железа(
Соединения железа(III)
Оксид и гидроксид железа(
Феррит кальция
Гидроксид железа(
Соли железа(
Соединения железа(
В щелочной среде соединения железа(
Феррат калия
Ферраты являются сильными окислителями.
Качественные реакции на катионы железа
Качественная реакция на ион железа(

Рис. 2. Качественная реакция на катионы железа(
Другим реагентом на ионы железа(
Аналогичное синие окрашивание осадка того же состава можно получить при взаимодействии ионов железа(
При работе с кровяными солями следует помнить об их токсичности.

Рис. 3. Качественная реакция на катионы железа
Используя учебник, параграф 49, ответьте на вопрос, как еще можно различить ионы железа?
№1. Осуществите превращения:
FeCl2 -> Fe(OH)2 -> FeO -> FeSO4
Fe -> Fe(NO3)3 -> Fe(OH)3 -> Fe2O3-> NaFeO2
№2. Составьте уравнения реакций, при помощи которых можно получить:
а) соли железа (II) и соли железа (III);
б) гидроксид железа (II) и гидроксид железа (III);
в) оксиды железа.
13.04
Тема урока: Железо
Здравствуйте ребята. Запишите тему урока.
Посмотрите видеоурок по теме ССЫЛКА
Откройте и прочитайте параграф 48.
Выполните задания № 1-4 страница 173 (письменно)
12.04
Тема урока: Решение задач на избыток
АЛГОРИТМ
Задачи на избыток и недостаток
Классический пример задачи на избыток и недостаток.
Этапы решения задачи:
1. Записываем уравнение реакции и уравниваем его:
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(Cu) = m\Ar =3.2 г \ 63.5 г\моль = 0,05 моль
m(Hg(NO3)2) = m\Mr = 20 \ 324 = 0,06 моль
3. Сравниваем количество моль веществ и определяем недостаток:
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
0,05 моль 0,06 моль
по уравнению реакции меди и нитрат ртути реагируют 1:1, значит, их количество моль тоже должно быть одинаковым
0,05 моль < 0,06 моль — медь в недостатке
ЗАПОМНИТЕ! Задачи на избыток и недостаток всегда решаются ПО НЕДОСТАТКУ
Вычисляем массу продукта по количеству моль, соответствующему недостатку:
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
0,05 моль ——> 0,05 моль
m(Hg)= n*Ar = 0,05 моль * 200 г\моль = 10 г
Посмотрите видеофрагмент ССЫЛКА и запишите примеры решенных задач
Домашнее задание: пройдите тест ССЫЛКА Задание можно выполнить только сегодня
06.04
Тема: Амфотерность соединений алюминия.
Посмотрите видеофрагмент ССЫЛКА
Запишите краткую характеристику соединений алюминия.
Соединения алюминия
Al2O3 – твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется.
Типичный амфотерный оксид, поэтому реагирует с кислотами и щелочами.
Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O
При сплавлении образуется метаалюминат натрия:
Al2O3 (тв)+ 2 NaOH (тв) t→ 2 NaAlO2 + H2O,
В растворе щёлочи образуется тетрагидроксоалюминат натрия:
Al2O3 + 2 NaOH + 3 H2O = 2Na[Al(OH)4]
Алюминаты неустойчивы и даже при слабом подкислении разрушаются:
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
Al(OH)3 – белое вещество, нерастворимое в воде, амфотерный гидроксид.
Получают косвенно реакцией обмена между солью алюминия и щелочью:
AlCl3 + NaOH (по каплям)= Al(OH)3 ↓ + 3 NaCl
Взаимодействует с кислотами и щелочами.
Al(OH)3 + 3 HCl = AlCl3 + 3 H2O
В растворе: Al(OH)3 + NaOH(избыток) = Na[Al(OH)4]
или Al(OH)3 + 3 NaOH = Na3[Al(OH)6]
В расплавах: Al(OH)3 + NaOH = NaAlO2 + 2H2O
домашнее задание:п.47
30.03
Тема урока: Щелочноземельные металлы. Кальций и его соединения. Жесткость воды
Здравствуйте ребята. Для проверки домашнего задания пройдите тест ССЫЛКА . Тест выполнить до 20.00
Мы изучаем тему: «Металлы». Вспомнив бронзовый и железный века на заре человечества и просто оглянувшись вокруг, мы можем осознать роль металлов в жизни людей. Металлы имеют много общего, но порой очень не похожи друг на друга. Почему одни металлы можно хранить на воздухе, а другие в специальной посуде? Почему некоторые металлы относят к макроэлементам (или биоэлементам), а другие - к микроэлементам. В конце концов, как связаны между собой такие отрасли хозяйства как строительство и медицина, производство стекла и пищевая промышленность?
Просмотрите видеофрагмент по ССЫЛКЕ до 4 минуты 40 секунды (Жесткость воды)
Используя вопросы плана дайте письменные ответы на 1-3 вопросы
План
1. Положение элементов в ПСХЭ и строение на его основе
2. Физические свойства металлов главной подгруппы II группы ПС.
3. Химические свойства металлов главной подгруппы II группы ПС.
4. Распространение в природе. Соединения магния и щелочноземельных металлов.
5.Биологическая роль. История открытия изучаемых элементов.
Вернитесь к видеоуроку и просмотрите его полностью..
Домашнее задание: параграф 44,45 № 3,4 стр.163 (письменно)
23.03
Тема урока: Общая характеристика металлов
Здравствуйте ребята
Сегодня мы приступаем к изучению нового раздела неорганической химии – химии металлов.

Домашнее задание: прочитать параграфы 40-42
15.03
Тема урока: Понятие об органической химии.
Здравствуйте ребята. Запишите число и тему урока.
Познакомьтесь с материалом параграфа 51. Запишите краткие ответы на вопросы 1-3, 5 страница 180.
Рассмотрите схему
Домашнее задание: Заполнить таблицу (задание №4 стр.199) по п.52-58
11.02
Тема урока: Общая характеристика подгруппы углерода. Углерод
Здравствуйте ребята. Запишите число и тему урока. Используя теоретический материал, составьте опорный конспект по данной теме в удобной для вас форме.
1. Общая характеристика элементов подгруппы углерода
К химическим элементам главной подгруппы IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. В ряду C — Si — Ge — Sn — Pb из-за различной химической природы элементов их разбивают на две подгруппы: углерод и кремний составляют подгруппу углерода, германий, олово, свинец — подгруппу германия.
Электронные конфигурации внешнего слоя атомов элементов ns2np2, в соединениях они могут проявлять степени окисления от –4 до +4. Как и в главной подгруппе V группы, наблюдается изменение химических свойств элементов: углерод и кремний проявляют свойства типичных неметаллов, для германия характерны переходные свойства, а олово и свинец — типичные металлы. С увеличением атомного номера в подгруппе уменьшается электроотрицательность элементов. Для углерода и кремния характерны ковалентные соединения, для олова и свинца — ионные.
в ряду C — Si — Ge — Sn — Pb наблюдается монотонное изменение свойств от неметаллических к металлическим. Это проявляется в уменьшении устойчивости соединений элементов в высшей степени окисления +4 и возрастании стабильности соединений элементов в низкой степени окисления +2. Для C, Si и Ge не характерно образование свободных катионов, Sn и Pb легко образуют катионы Sn2+ и Pb2+.
Об усилении металлических свойств свидетельствует изменение кислотно-основных свойств оксидов и гидроксидов элементов в степени окисления +4 при переходе от углерода к свинцу:
CO2 | SiO2 | GeO2 | SnO2 PbO2 |
кислотные свойства | слабо | амфотерные свойства | амфотерные свойства |
Кислотные свойства соответствующих гидроксидов изменяются аналогично.
В ряду от углерода до свинца усиливается устойчивость оксидов элементов в степени окисления +2.
Углерод существует в природе в виде двух устойчивых изотопов: 12C (98,9%) и 13C (1,1%).
Большое значение имеет b -радиоактивный изотоп углерода 14C. В основе радиоуглеродного метода определения возраста углеродсодержащих пород лежит вычисление соотношения долей стабильных и радиоактивного изотопов углерода.
Углерод занимает 11-е место по распространенности на Земле. Он встречается в атмосфере в виде CO2, из него образованы многие минералы и горные породы, например мел, известняк, мрамор (химическая формула которых CaCO3), доломит (MgCO3 · CaCO3), малахит (CuCO3 · Cu(OH)2). Углерод входит в состав белков, нуклеиновых кислот, углеводов — веществ, без которых невозможна жизнь.
Почти во всех соединениях (кроме CO и SiO) углерод и кремний четырехвалентны. Атомы углерода во многих соединениях образуют цепи –C–C–. Для соединений кремния также характерна полимерная структура, но в отличие от атомов углерода атомы кремния образуют разветвленные цепи, соединяясь не друг с другом, а через кислород –Si–O–Si–.
Углерод образует несколько простых веществ: алмаз, графит, карбин, фуллерен и аморфный углерод.
АЛМАЗ представляет собой бесцветные прозрачные, сильно преломляющие свет кристаллы плотностью 3,52 г/см3. Строение внешнего энергетического уровня атома углерода в невозбужденном состоянии описывает электронная конфигурация 2s22p2. При образовании химических связей в атоме углерода распариваются электроны, находящиеся на s-подуровне, и он приобретает конфигурацию 2s12p3. Орбитали четырех неспаренных электронов подвергаются sp3-гибридизации, приводящей к образованию четырех равноценных гибридных орбиталей, угол между которыми равен тетраэдрическому. Атомы, находящиеся в sp3-гибридном состоянии, и образуют структуру алмаза. Алмаз — высокопрочное вещество, имеющее уникальную твердость и отличную преломляющую способность, что важно для создания абразивных материалов, режущих инструментов и ювелирных украшений.
ГРАФИТ — это серая непрозрачная жирная на ощупь масса плотностью 2,27 г/см3. В графите атомы углерода находятся в sp2-гибридном состоянии, что обусловливает слоистую структуру графита, состоящую из плоских шестиугольников. Расстояния между атомами углерода, находящимися в разных слоях, превосходят расстояния между атомами внутри слоя. Слоистой структурой графита объясняются его электро- и теплопроводность, а также способность оставлять след на твердой поверхности. Для превращения алмаза в графит необходимо нагревание до 1800–1850 ° С без доступа воздуха. Обратный процесс идет при температуре 3000 ° С и давлении 106–107 кПа.
Графит широко применяют в качестве электродного материала в электрохимии; он входит в состав смазок, используется в качестве замедлителя нейтронов в ядерных реакторах.
КАРБИН представляет собой кристаллический порошок черного цвета плотностью 1,9 г/см3. Для его получения используют реакцию дегидрирования ацетилена при 1000 ° С, в результате которой из n молекул C2H2 получается полимер с линейной структурой –C º C–C º C–C º C–. В этой модификации атомы углерода находятся в sp-гибридном состоянии.
ФУЛЛЕРЕНЫ были обнаружены в продуктах конденсации паров графита. Молекула фуллерена C 60 представляет соединенные между собой пяти и шестичленные циклы, содержащие углерод в sp 2 и sp 3 – гибридном состоянии. Кроме C 60 делены фуллерены состава C 70 и C 76 .
АМОРФНЫЙ УГЛЕРОД — самая распространенная аллотропная модификация углерода. Чаще всего его получают при разложении различных органических веществ. Иногда эту форму называют древесным или активированным углем.
КРЕМНИЙ — самый распространенный после кислорода элемент в земной коре (27,6% по массе). Он имеет три стабильных изотопа: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%). В природе кремний находится в виде кремнезема — оксида кремния(IV) SiO2 (иногда его называют кварц или песок), силикатов и алюмосиликатов, например слюды KAl3[Si3O10](OH,F)2, асбеста (Mg,Fe)6[Si4O10](OH)6, талька Mg3[Si4O10](OH)2. В зависимости от размеров частиц и содержания примесей в SiO2 при его восстановлении можно получить различные модификации кремния.
Аморфный кремний представляет собой бурый порошок, кристаллический — светло-серые твердые хрупкие кристаллы металлического вида. В кристаллической решетке каждый атом кремния находится в состоянии sp3-гибридизации и окружен четырьмя другими атомами, с которыми он связан ковалентной связью — кристаллический кремний подобен алмазу.
Кремний широко используется в микроэлектронике в качестве полупроводникового материала для микросхем и в металлургии для получения чистых металлов.
2. Химические свойства углерода и кремния
1. В реакциях с простыми веществами, образованными более электроотрицательными элементами (кислород, галогены, азот, сера), углерод и кремний проявляют свойства восстановителей. При нагревании графита и кремния с избытком кислорода образуются высшие оксиды, а при недостатке кислорода — монооксиды CO и SiO:
С + O2 = СO2 (избыток кислорода);
2С + O2 = 2СO (недостаток кислорода).
Со фтором углерод и кремний реагируют при обычных условиях с образованием тетрафторидов CF4 и SiF4, для получения тетрахлоридов CCl4 и SiCl4 необходимо нагревание реагирующих веществ. Сера и азот вступают в реакции с углеродом и кремнием только при сильном нагревании:
C + 2S= CS2;
2C + N2 =C2N2;
Si + 2S =SiS2.
При нагревании смеси кварцевого песка и кокса при температуре около 2000 ° С образуется карбид кремния, или карборунд — тугоплавкое вещество, по твердости близкое к алмазу:
SiO2 + 3C = SiC + 2CO.
Углерод часто используют для восстановления малоактивных металлов из их оксидов и для перевода сульфатов металлов в сульфиды:
CuO + C = Cu + CO ,
BaSO4 + 4C = BaS + 4CO.
2. Реакции с кислотами. К действию обычных кислот углерод и кремний устойчивы. Углерод окисляется концентрированными серной и азотной кислотами:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
3C + 4HNO3 = 3CO2 + 4NO + 2H2O.
Кремний в концентрированных серной и азотной кислотах пассивируется и растворяется в смесях концентрированных азотной и плавиковой кислот и : концентрированных азотной и соляной кислот
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O.
В этой реакции азотная кислота играет роль окислителя, а плавиковая или соляная — комплексообразователя.
3. Реакции со щелочами. Кремний растворяется в водных растворах щелочей с выделением водорода:
Si + 2NaOH + H2O = Na2SiO3 + 2 H 2 .
4. Взаимодействие с водой. В обычных условиях кремний с водой не взаимодействует, но при высокой температуре он реагирует с водяным паром:
Si +H2O = H2SiO3 + 2H2 .
5. Окислительные свойства углерода и кремния проявляются в реакциях с активными металлами, при этом образуются карбиды и силициды:
Ca + 2C = CaC2;
2Mg + Si = Mg2Si.
6. Углерод и кремний способны диспропорционировать при нагревании с оксидами активных металлов, образуя оксиды, карбиды и силициды:
CaO + 3C = CaC2 + CO ;
2Al2O3 + 9C = Al4C3 + 6CO ;
2MgO + 3Si = Mg2Si + 2SiO.
Домашнее задание: №4 стр.114 , №4стр.117
04.02
Тема урока: Решение задач на выход продукта
Здравствуйте ребята. Запишите число и тему урока.
Посмотрите видеофрагмент ССЫЛКА. Запишите примеры решенных задач.
Решите самостоятельно
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Пройдите тест по ССЫЛКА ЗДЕСЬ
Ответы отправить до 08.02
1 семестр
13.11
Химические реакции
Здравствуйте ребята! Мы заканчиваем тему "Электролитическая диссоциация" Сегодня выполним самостоятельную работу. Она будет состоять из двух частей:
1. ТЕСТ (выполнить до 18.00 14.11) ссылка ЗДЕСЬ
2. Выполнение письменного задания на отдельных листах (сдадите 15.11 )
Задание:
Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO3 =
- H2SO4 + MgO =
- Ca(NO3)2 + Na3PO4 =
Напишите полные ионные уравнения, описывающие взаимодействие: а)водных растворов сульфата меди и сульфида калия, б) гидроксида кальция и водного раствора нитрата железа (III).
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации - вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H+, точнее, H3O+) и анионы хлора (Cl-). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na+ и Br- (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая "обычные" (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H2O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H+ и Cl-. Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O. (2)
Это и есть полное ионное уравнение. Вместо "виртуальных" молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H2O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы - катионы Na+ и анионы Cl-. В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H+ + OH- = H2O. (3)
Как видите, все сводится к взаимодействию ионов H+ и OH- c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H2O - молекулярное уравнение ("обычное" уравнения, схематично отражающее суть реакции);
- H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O - полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H+ + OH- = H2O - краткое ионное уравнение (мы убрали весь "мусор" - частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем "в виде молекул".
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ - краткое ионное уравнение.
Пример 1. Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение. Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия - это две соли. Заглянем в опорный конспект "Соли" за 8 класс. Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO4 в "молекулярной форме" (т.к. не диссоциирует) Получаем следующее:
Ba2+ + 2Cl- + 2Na+ + SO42- = BaSO4↓ + 2Cl- + 2Na+.
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na+ и анионы Cl-. Стираем их и получаем краткое ионное уравнение:
Ba2+ + SO42- = BaSO4↓.
12.11
Реакции ионного обмена
Здравствуйте ребята!
ССЫЛКА ЗДЕСЬ
домашнее задание: повторить тему, подготовиться к с.р.
10.11
Тема: Реакции обмена между растворами электролитов. Ионные уравнения
Здравствуйте ребята!
Начинаем наш урок с просмотра видеофрагмента по данной теме. Внимательно слушайте объяснение учителя, запишите в тетради сегодняшнее число, тему урока и все примеры уравнений по ходу изложения материала (Задания учителя в видео выполнять не нужно).
Видеоурок ссылка
Задания для закрепления пройденного материала
Допишите уравнения возможных реакций, напишите полные и сокращенные ионные уравнения этих реакций. В каждом случае назовите признак реакции, по которому можно судить о возможности ее протекания
BaCl2 + MgSO4 =
NaNO3 + MgCl2 =
Домашнее задание: напишите полные и сокращенные ионные уравнения этих реакций:
азотная кислота + гидроксид калия =
карбонат калия + серная кислота =
2020-2021учебный год
2 семестр
30.04
Понятие о металлургии
Здравствуйте ребята. Посмотрите видеоурок по ССЫЛКЕ
Запишите в конспекты основную информацию по уроку.
23.04 Подготовка к контрольной работе №2
Вариант 1.
Часть А.
При выполнении заданий выберите
номер одного правильного ответа.
1.Наиболее ярко металлические свойства проявляет
1)K 2)Be 3)Al 4)Na
2.Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса:
1)Al→Mg→Na 3)K→Na→Li
2)Ca→Ba→Be 4)K→Ca→Al
3.Электронная конфигурация внешнего электронного слоя….3s23p1 соответствует атому
1)алюминия 2)бора 3)скандия 4)калия
4.Реактивом
на ион ![]() является ион
является ион
1)![]() 2)
2)![]() 3)
3)![]() 4)
4)![]()
5.Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары
1)Na и Cu 2) Na и K
3)K и Zn
4)Cu и Hg
6.С растворами кислот будут взаимодействовать оба металла
1)Na и Cu 2) K и Hg 3)K и Zn 4)Cu и Hg
7.При взаимодействии цинка с водой при нагревании образуется
1)Соль и вода 3)оксид
металла и водород
2)основание и
водород 4)реакция не
протекает
8.С водой с образованием основания и водорода будет взаимодействовать
1)Na 2)Zn 3)Cu 4)Ag
9.Амфотерный оксид образуется при взаимодействии кислорода и
1)натрия
3)алюминия
2)магния 4)бария
10.Для вытеснения меди из раствора её соли можно использовать
1)кальций 3)цинк
2)литий 4) серебро
Часть В.
В1.Установите соответствие между правой и левой частями уравнений
|
1) NaCl+AgNO3→ |
А)Fe(OH)3↓+3NaCl |
|
2)CuSO4+BaCl2→ |
Б)Cu↓+FeCl2 |
|
3)Fe+CuCl2→ |
B)Fe(OH)2+2NaCl |
|
4)2NaOH+FeCl2→ |
Г)NaNO3+AgCl |
|
|
Д)CuCl2+BaSO4↓ |
В2.Напишите уравнения реакций, соответствующих превращениям, укажите условия их протекания:
Fe→ FeCl2→Fe(OH)2→ Fe(OH)3→ Fe2O3→ Fe2(SO4)3
↓
FeCl3
В3.Какая масса меди образуется при взаимодействии 2 моль железа с раствором, содержащим 16г сульфата меди(II)?
Вариант 2.
Часть А.
При выполнении заданий выберите
номер одного правильного ответа.
1.Наиболее ярко металлические свойства проявляет
1)Ca 2)Be 3)Mg 4)K
2.Ряд, в котором элементы расположены в порядке уменьшения их атомного радиуса:
1)Al→Mg→Na 3)K→Na→Li
2)Ca→Ba→Be 4)Ca→ K→Al
3.Электронная конфигурация внешнего электронного слоя….2s22p1 соответствует атому
1)алюминия 2)бора 3)скандия 4)калия
4.Реактивом
на ион ![]() является ион
является ион
1)![]() 2)
2)![]() 3)
3)![]() 4)
4)![]()
5.Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары
1)K и Cu 2) Na и K
3)Na и Zn
4)Cu и Hg
6.С растворами кислот будут взаимодействовать оба металла
1)K и Cu 2) Na и Hg 3)K и Mn 4)Cu и Hg
7.При взаимодействии магния с водой образуется
1)Соль и вода 3)оксид
металла и водород
2)основание и
водород 4)реакция не
протекает
8.С водой с образованием оксида металла и водорода при нагревании будет взаимодействовать
1)Na 2)Zn 3)Cu 4)Ag
9.Амфотерный оксид образуется при взаимодействии кислорода и
1)натрия
3)алюминия
2)магния 4)бария
10.Для вытеснения меди из раствора её соли можно использовать
1)калий
3)железо
2)золото 4) натрий
Часть В.
В1.Установите соответствие между правой и левой частями уравнений
|
1) CaCl2+2NaOH→ |
А)FeCl2+H2↑ |
|
2)2K+2H2O→ |
Б) FeCl3+H2↑ |
|
3)3NaOH+FeCl3→ |
B)Ca(OH)2↓+2NaCl |
|
4)2HCl+Fe→ |
Г)3NaCl+Fe(OH)3↓ |
|
|
Д)2KOH+H2↑ |
В2.Напишите уравнения реакций, соответствующих превращениям,
укажите условия их протекания:
Al→Al2O3→AlCl3→Al(OH)3→Al2(SO4)3→Al(NO3)3
↓
NaAlO2
В3.Какая масса осадка образуется при взаимодействии 4г гидроксида натрия с 2 моль хлорида железа (II)?
16.04
Тема урока: Соединения железа(II) и железа(III).
Здравствуйте ребята. Запишите в тетради тему урока.
Пройдите по ССЫЛКЕ
№1. Осуществите превращения:
FeCl2 -> Fe(OH)2 -> FeO -> FeSO4
Fe -> Fe(NO3)3 -> Fe(OH)3 -> Fe2O3-> NaFeO2
№2. Составьте уравнения реакций, при помощи которых можно получить:
а) соли железа (II) и соли железа (III);
б) гидроксид железа (II) и гидроксид железа (III);
в) оксиды железа.
09.04
Тема: Амфотерность соединений алюминия. Решение задач на избыток
Посмотрите видеофрагмент ССЫЛКА
Запишите краткую характеристику соединений алюминия.
Соединения алюминия
Al2O3 – твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется.
Типичный амфотерный оксид, поэтому реагирует с кислотами и щелочами.
Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O
При сплавлении образуется метаалюминат натрия:
Al2O3 (тв)+ 2 NaOH (тв) t→ 2 NaAlO2 + H2O,
В растворе щёлочи образуется тетрагидроксоалюминат натрия:
Al2O3 + 2 NaOH + 3 H2O = 2Na[Al(OH)4]
Алюминаты неустойчивы и даже при слабом подкислении разрушаются:
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
Al(OH)3 – белое вещество, нерастворимое в воде, амфотерный гидроксид.
Получают косвенно реакцией обмена между солью алюминия и щелочью:
AlCl3 + NaOH (по каплям)= Al(OH)3 ↓ + 3 NaCl
Взаимодействует с кислотами и щелочами.
Al(OH)3 + 3 HCl = AlCl3 + 3 H2O
В растворе: Al(OH)3 + NaOH(избыток) = Na[Al(OH)4]
или Al(OH)3 + 3 NaOH = Na3[Al(OH)6]
В расплавах: Al(OH)3 + NaOH = NaAlO2 + 2H2O
Домашнее задание: посмотрите видеофрагмент ССЫЛКА и запишите примеры решенных задач
«Кальций и его соединения. Жесткость воды
Посмотрите видеофрагмент - урок за 19.03 полностью
19.03 Щелочноземельные металлы
Здравствуйте ребята. Для проверки домашнего задания пройдите тест ССЫЛКА . Тест выполнить до 20.00
Мы изучаем тему: «Металлы». Вспомнив
бронзовый и железный века на заре человечества и просто оглянувшись вокруг, мы
можем осознать роль металлов в жизни людей. Металлы имеют много общего, но
порой очень не похожи друг на друга. Почему одни металлы можно хранить на
воздухе, а другие в специальной посуде? Почему некоторые металлы относят к
макроэлементам (или биоэлементам), а другие -
к микроэлементам. В конце концов, как связаны между собой такие отрасли
хозяйства как строительство и медицина, производство стекла и пищевая
промышленность?
Просмотрите видеофрагмент по ССЫЛКЕ до 4 минуты 40 секунды (Жесткость воды)
Используя вопросы плана дать письменные ответы на 1-3 вопросы
План
1. Положение элементов в ПСХЭ и строение
на его основе
2. Физические свойства металлов главной подгруппы II группы ПС.
3. Химические свойства металлов главной подгруппы II группы ПС.
4. Распространение в природе. Соединения
магния и щелочноземельных металлов.
12.03
Общая характеристика металлов
Здравствуйте ребята
Сегодня мы приступаем к изучению нового раздела неорганической химии – химии металлов.
Теоретический материал к опорным конспектам ССЫЛКА
05.03
Решение расчетных задач. Подготовка к самостоятельной работе
Здравствуйте ребята
Готовимся к самостоятельной работе. Ответьте на вопросы тестов
1. Высшую степень окисления атом кремния проявляет в
1) SiH4
2) SiO 3) SiO2
4) Mg2Si
2. Углерод проявляет окислительные свойства в реакции
1) C+O2
=CO2 2) С + 2CuO = 2Cu + CO2
3) ЗС + 4AI = АI4С3
4) C+H2O=CO+H2
3. Для увеличения растворимости
оксида углерода (IV) в воде, где
происходит реакция СО2 + H2O = Н2СО3 + Q, необходимо
1) повышение
давления
3)
применение катализатора
2) повышение
температуры 4) перемешивание раствора
4. Электронное строение внешнего
энергетического уровня атома кремния 1) 2s22p2 2) З s2Зр2 3) 2s22p4 4) Зs23p4
5. Кремний проявляет окислительные свойства в реакции 1) Si+02=Si02 2) Si + 2CuO = 2Cu + SiO2
3) Si+2Mg=Mg2Si
4) Si + 2NaOH + H2O = Na2SiO3 +
2H2
6. Укажите неверное утверждение. Углекислый
газ 1) имеет
запах 2)
содержится в атмосферном воздухе 3)
бесцветен 4) реагирует с водой
Решите задачи
1.
При
обжиге
2.
При
нейтрализации соляной кислоты содой (Na2СОз, Мг = 106) выделилось 5.6л углекислого газа (н.у.). Масса соды, вступившей
в реакцию, равна 1) 53 г 2) 26,5 r 3) 17,75 г 4) 13,25г
3. При нейтрализации соляной кислоты содой (Na2СОз, Мг = 106) выделилось 5.6л углекислого газа (н.у.). Масса соды, вступившей в реакцию, равна 1) 53 г 2) 26,5 r 3) 17,75 г 4) 13,25г
4. Объем углекислого
газа (н.у.), вступившего в реакцию с гидроксидом бария с образованием
19.02
Тема урока: Кремний. Оксид кремния(IV). Кремниевая кислота и ее соли.
Здравствуйте ребята. Запишите в тетради опорный конспект по теме урока.
Домашнее задание: читать параграфы 37,38 решить № 3 стр. 134, № 5 стр. 137 (по желанию)
15.02 Урок проводится в очной форме
12.02
Тема урока: Углекислый газ, угольная кислота и ее соли.
Здравствуйте ребята. Продолжим знакомство с соединениями углерода. Запишите число и тему урока.
Перейдите по ССЫЛКЕ на страницу, где представлен теоретический материал по данной теме.
Запишите характеристику углекислого газа, угольной кислоты и ее солей. Обратите внимание на химические реакции.
Домашнее задание: для подготовки к практической работе посмотрите опыты ССЫЛКА НА ВИДЕООПЫТЫ
Тема урока: Общая характеристика подгруппы углерода. Углерод
Здравствуйте ребята. Запишите число и тему урока. Используя теоретический материал, составьте опорный конспект по данной теме в удобной для вас форме.
1. Общая характеристика элементов подгруппы углерода
К химическим элементам главной подгруппы IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. В ряду C — Si — Ge — Sn — Pb из-за различной химической природы элементов их разбивают на две подгруппы: углерод и кремний составляют подгруппу углерода, германий, олово, свинец — подгруппу германия.
Электронные конфигурации внешнего слоя атомов элементов ns2np2, в соединениях они могут проявлять степени окисления от –4 до +4. Как и в главной подгруппе V группы, наблюдается изменение химических свойств элементов: углерод и кремний проявляют свойства типичных неметаллов, для германия характерны переходные свойства, а олово и свинец — типичные металлы. С увеличением атомного номера в подгруппе уменьшается электроотрицательность элементов. Для углерода и кремния характерны ковалентные соединения, для олова и свинца — ионные.
Некоторые свойства элементов главной подгруппы IV группы представлены в табл. 4.1.
Таблица 4.1
Свойства элементов
подгруппы углерода и простых веществ
Атомный номер | Название, символ | Радиус атома, нм | Потенциал ионизации, | ЭО | Степе ни | r , | t пл , | t кип , |
6 | Углерод C | 0,077 | 11,3 | 2,55 | –4, 0, +2, +4 | 3,52 алмаз 2,27 графит | 3730 | 4830 |
14 | Кремний Si | 0,117 | 8,2 | 1,90 | –4, 0, +2, +4 | 2,33 | 1410 | 2680 |
32 | Германий Ge | 0,122 | 7,9 | 2,01 | –4, 0, +2, +4 | 5,33 | 937 | 2830 |
50 | Олово Sn | 0,142 | 7,3 | 1,96 | –4, 0, +2, +4 | 7,29 | 232 | 2270 |
82 | Свинец Pb | 0,154 | 7,4 | 2,33 | 0, +2, +4 | 11,3 | 327 | 1730 |
Данные табл. 4.1 подтверждают, что в ряду C — Si — Ge — Sn — Pb наблюдается монотонное изменение свойств от неметаллических к металлическим. Это проявляется в уменьшении устойчивости соединений элементов в высшей степени окисления +4 и возрастании стабильности соединений элементов в низкой степени окисления +2. Для C, Si и Ge не характерно образование свободных катионов, Sn и Pb легко образуют катионы Sn2+ и Pb2+.
Об усилении металлических свойств свидетельствует изменение кислотно-основных свойств оксидов и гидроксидов элементов в степени окисления +4 при переходе от углерода к свинцу:
CO2 | SiO2 | GeO2 | SnO2 PbO2 |
кислотные свойства | слабо | амфотерные свойства | амфотерные свойства |
Кислотные свойства соответствующих гидроксидов изменяются аналогично.
В ряду от углерода до свинца усиливается устойчивость оксидов элементов в степени окисления +2.
Углерод существует в природе в виде двух устойчивых изотопов: 12C (98,9%) и 13C (1,1%).
Большое значение имеет b -радиоактивный изотоп углерода 14C. В основе радиоуглеродного метода определения возраста углеродсодержащих пород лежит вычисление соотношения долей стабильных и радиоактивного изотопов углерода.
Углерод занимает 11-е место по распространенности на Земле. Он встречается в атмосфере в виде CO2, из него образованы многие минералы и горные породы, например мел, известняк, мрамор (химическая формула которых CaCO3), доломит (MgCO3 · CaCO3), малахит (CuCO3 · Cu(OH)2). Углерод входит в состав белков, нуклеиновых кислот, углеводов — веществ, без которых невозможна жизнь.
Почти во всех соединениях (кроме CO и SiO) углерод и кремний четырехвалентны. Атомы углерода во многих соединениях образуют цепи –C–C–. Для соединений кремния также характерна полимерная структура, но в отличие от атомов углерода атомы кремния образуют разветвленные цепи, соединяясь не друг с другом, а через кислород –Si–O–Si–.
Углерод образует несколько простых веществ: алмаз, графит, карбин, фуллерен и аморфный углерод.
АЛМАЗ представляет собой бесцветные прозрачные, сильно преломляющие свет кристаллы плотностью 3,52 г/см3. Строение внешнего энергетического уровня атома углерода в невозбужденном состоянии описывает электронная конфигурация 2s22p2. При образовании химических связей в атоме углерода распариваются электроны, находящиеся на s-подуровне, и он приобретает конфигурацию 2s12p3. Орбитали четырех неспаренных электронов подвергаются sp3-гибридизации, приводящей к образованию четырех равноценных гибридных орбиталей, угол между которыми равен тетраэдрическому. Атомы, находящиеся в sp3-гибридном состоянии, и образуют структуру алмаза. Алмаз — высокопрочное вещество, имеющее уникальную твердость и отличную преломляющую способность, что важно для создания абразивных материалов, режущих инструментов и ювелирных украшений.
ГРАФИТ — это серая непрозрачная жирная на ощупь масса плотностью 2,27 г/см3. В графите атомы углерода находятся в sp2-гибридном состоянии, что обусловливает слоистую структуру графита, состоящую из плоских шестиугольников. Расстояния между атомами углерода, находящимися в разных слоях, превосходят расстояния между атомами внутри слоя. Слоистой структурой графита объясняются его электро- и теплопроводность, а также способность оставлять след на твердой поверхности. Для превращения алмаза в графит необходимо нагревание до 1800–1850 ° С без доступа воздуха. Обратный процесс идет при температуре 3000 ° С и давлении 106–107 кПа.
Графит широко применяют в качестве электродного материала в электрохимии; он входит в состав смазок, используется в качестве замедлителя нейтронов в ядерных реакторах.
КАРБИН представляет собой кристаллический порошок черного цвета плотностью 1,9 г/см3. Для его получения используют реакцию дегидрирования ацетилена при 1000 ° С, в результате которой из n молекул C2H2 получается полимер с линейной структурой –C º C–C º C–C º C–. В этой модификации атомы углерода находятся в sp-гибридном состоянии.
ФУЛЛЕРЕНЫ были обнаружены в продуктах конденсации паров графита. Молекула фуллерена C 60 представляет соединенные между собой пяти и шестичленные циклы, содержащие углерод в sp 2 и sp 3 – гибридном состоянии. Кроме C 60 делены фуллерены состава C 70 и C 76 .
АМОРФНЫЙ УГЛЕРОД — самая распространенная аллотропная модификация углерода. Чаще всего его получают при разложении различных органических веществ. Иногда эту форму называют древесным или активированным углем.
КРЕМНИЙ — самый распространенный после кислорода элемент в земной коре (27,6% по массе). Он имеет три стабильных изотопа: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%). В природе кремний находится в виде кремнезема — оксида кремния(IV) SiO2 (иногда его называют кварц или песок), силикатов и алюмосиликатов, например слюды KAl3[Si3O10](OH,F)2, асбеста (Mg,Fe)6[Si4O10](OH)6, талька Mg3[Si4O10](OH)2. В зависимости от размеров частиц и содержания примесей в SiO2 при его восстановлении можно получить различные модификации кремния.
Аморфный кремний представляет собой бурый порошок, кристаллический — светло-серые твердые хрупкие кристаллы металлического вида. В кристаллической решетке каждый атом кремния находится в состоянии sp3-гибридизации и окружен четырьмя другими атомами, с которыми он связан ковалентной связью — кристаллический кремний подобен алмазу.
Кремний широко используется в микроэлектронике в качестве полупроводникового материала для микросхем и в металлургии для получения чистых металлов.
2. Химические свойства углерода и кремния
1. В реакциях с простыми веществами, образованными более электроотрицательными элементами (кислород, галогены, азот, сера), углерод и кремний проявляют свойства восстановителей. При нагревании графита и кремния с избытком кислорода образуются высшие оксиды, а при недостатке кислорода — монооксиды CO и SiO:
С + O2 = СO2 (избыток кислорода);
2С + O2 = 2СO (недостаток кислорода).
Со фтором углерод и кремний реагируют при обычных условиях с образованием тетрафторидов CF4 и SiF4, для получения тетрахлоридов CCl4 и SiCl4 необходимо нагревание реагирующих веществ. Сера и азот вступают в реакции с углеродом и кремнием только при сильном нагревании:
C + 2S= CS2;
2C + N2 =C2N2;
Si + 2S =SiS2.
При нагревании смеси кварцевого песка и кокса при температуре около 2000 ° С образуется карбид кремния, или карборунд — тугоплавкое вещество, по твердости близкое к алмазу:
SiO2 + 3C = SiC + 2CO.
Углерод часто используют для восстановления малоактивных металлов из их оксидов и для перевода сульфатов металлов в сульфиды:
CuO + C = Cu + CO ,
BaSO4 + 4C = BaS + 4CO.
2. Реакции с кислотами. К действию обычных кислот углерод и кремний устойчивы. Углерод окисляется концентрированными серной и азотной кислотами:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
3C + 4HNO3 = 3CO2 + 4NO + 2H2O.
Кремний в концентрированных серной и азотной кислотах пассивируется и растворяется в смесях концентрированных азотной и плавиковой кислот и : концентрированных азотной и соляной кислот
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O.
В этой реакции азотная кислота играет роль окислителя, а плавиковая или соляная — комплексообразователя.
3. Реакции со щелочами. Кремний растворяется в водных растворах щелочей с выделением водорода:
Si + 2NaOH + H2O = Na2SiO3 + 2 H 2 .
4. Взаимодействие с водой. В обычных условиях кремний с водой не взаимодействует, но при высокой температуре он реагирует с водяным паром:
Si +H2O = H2SiO3 + 2H2 .
5. Окислительные свойства углерода и кремния проявляются в реакциях с активными металлами, при этом образуются карбиды и силициды:
Ca + 2C = CaC2;
2Mg + Si = Mg2Si.
6. Углерод и кремний способны диспропорционировать при нагревании с оксидами активных металлов, образуя оксиды, карбиды и силициды:
CaO + 3C = CaC2 + CO ;
2Al2O3 + 9C = Al4C3 + 6CO ;
2MgO + 3Si = Mg2Si + 2SiO.
Домашнее задание: подготовиться к опросу
02.02 Урок проводится в очной форме.
Самостоятельная работа по теме "Подгруппа азота"
29.01
Тема урока: Оксид фосфора (V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Здравствуйте ребята.
Запишите в тетради число и тему урока.
Прочитайте параграф № 30. Обратите внимание на таблицу "Химические свойства ортофосфорной кислоты.
Выполните письменно задание №1 и 3 стр. 110
Для подготовки к самостоятельной работе пройдите тест ПО ССЫЛКЕ
Домашнее задание: повторите тему "Подгруппа азота"
25.01 урок проводится в очной форме
Тема урока: Фосфор
д.з. п.29 № 4 стр.105
22.01
Тема урока: Азотная кислота и ее соли.
Посмотрите видеоурок по ССЫЛКЕ
Запишите все уравнения реакций, характеризующие свойства азотной кислоты.
19.01 Урок проводится в очном режиме
Тема урока: Оксиды азота
Итоговая таблица (Для тех, кто отсутствовал на уроке)
15.01
Тема урока: Соли аммония
Здравствуйте ребята!
Запишите в тетради число и тему урока.
Посмотрите, внимательно, видеоурок по ССЫЛКЕ
Запишите в рабочую тетрадь информацию, которая представлена на доске учителя
Выполните в тетрадях № 3 стр.91
Домашнее задание читать п. 26, выполнить тест записать только цифры.
АЛЬТЕРНАТИВНЫЙ ТЕСТ (выпишите цифры , которые характеризуют свойства газов)
1.
Газообразный при
обычных условиях
2.
Не имеет запаха
3.
Бесцветный
4.
В воде
малорастворим
5.
Степень окисления
азота -3
6.
В воздухе не
горит
7.
Горит в кислороде
8.
Взаимодействует с
кислотами с образованием солей
9.
В молекуле между
атомами ковалентная полярная связь
10. Взаимоотношение с
водородом в присутствии катализатора
11. он является важнейшим
биогенным элементом.
12. водный раствор имеет
щелочную среду
13. он проявляет только
восстановительные свойства
14. в атмосфере этого газа хранят
рукописи
15. он легко сжижается и
поэтому применяется в холодильных условиях (проверяем, обмениваемся тетрадями)
|
азот |
аммиак |
|
|
|
12.01 Пр. раб. №3 .Получение аммиака и изучение его свойств.
Фамилия, имя
класс
Двенадцатое января
Практическая работа № 3
Получение аммиака и изучение его свойств.
Цель: получить аммиак реакцией ионного обмена и изучить свойства этого газа и его водного раствора – гидроксида аммония.
Оборудование: прибор для получения аммиака, NH4CI, Ca (OH)2, H2O, стеклянные палочки, чашки Петри, фенолфталеин, нагревательный прибор, штатив.
Инструктаж по ТБ:
1.Экономное
расходование веществ.
2.При
выяснении запаха веществ не подносите сосуд близко к лицу, иначе вдыхание паров
и газов может вызвать раздражение дыхательных путей.
3.Проводите
опыты только над столом, нагревая пробирку с жидкостью, держите её так, чтобы
открытый конец её был направлен в сторону и от самого себя и от соседей.
4.Не
приступайте к выполнению опыта, не зная, что и как нужно делать.
______________
Ход работы
Опыт 1. Получение аммиака.
На лист
бумаги или в небольшую фарфоровую чашку (можно ступку) насыпьте хлорид аммония
и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ).
Смесь
перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее
пробкой с газоотводной трубкой и укрепите в лапке штатива.
При
укреплении прибора в лапке штатива обратите внимание на наклон пробирки
относительно ее отверстия. На газоотводную трубку наденьте сухую пробирку для
собирания аммиака.
Пробирку
со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3
движения пламени), а затем нагрейте в том месте, где находится смесь.
Почему пробирка вверх дном? ( NH3 легче воздуха в 2 раз).
Как вы узнаете, что получили NH3?
1)по запаху (резкий запах);
2)поднесите к
отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку(она
стала малиновой).
1). 2NH4CI + Ca (OH )2 = CaCI2 + 2NH3↑ + 2H2O
2)Не переворачивая пробирку, быстро опустите её в чашку с водой отверстием вниз, подержите так, капните фенолфталеин. Что произошло? Какое вещество мы получили?
Аммиак
очень хорошо растворим в воде!
NH3 + H2O = NH4OH
аммиачная вода,
нашатырный спирт,
среда щелочная,
3)Получение „дыма без огня”
NH3 + HCI = NH3 + HNO3 =
В результате этих реакций мы получили
какие вещества? (соли аммония).
Вывод:получили аммиак, обнаружили по резкому запаху, имеет основной характер, хорошо растворим в воде, образуя основание, аммиачную воду, взаимодействует с кислотами, образуя соли.
Опыт 2.Изучение свойств водного раствора аммиака.
1.NH4OH + 2,3 капли фенолфталеина → малиновая окраска
Почему?
NH4OH → NH3 ↑+H2O
1.
NH4OH + 2,3 капли фенолфталеина → малиновая окраска, + HCI
Как
изменился цвет? Почему?
NH4OH +HCI = NH4CI + H2O
![]()
![]() NH4 + + OH- + H+ + CI- = NH4 + + CI- + Н2О
NH4 + + OH- + H+ + CI- = NH4 + + CI- + Н2О
Н+ + ОН- = Н2О реакция
нейтрализации
2. АICI3 + 3NH4OH = 3NH4CI + AI
(OH)3↓
AI3+ + 3CI- + 3NH4+ + 3OH- = 3NH4+ + 3CI- + AI (OH)3↓
![]()
![]()
AI3+ + 3OH- = AI (OH)3↓
Вывод: при изучении свойств водного раствора NH3 выяснили, что это основание, разлагается при нагревании, взаимодействует с кислотами и солями.
18.12 Вычисления по химическим уравнениям
Здравствуйте ребята.
Повторите предыдущий теоретический материал
Пройдите тест по ССЫЛКЕ Ответы на вопросы теста прислать сегодня до 20.00
Решите задачи в рабочей тетради ( подготовка к самостоятельной работе)
1. При
окислении 17,32 л оксида серы (IV)
образовалось 60г оксида серы (VI).
Определить, какую массовую долю составляет этот выход от теоретического.
2. Вычислить
массу серной кислоты, которая содержится в 400мл раствора с массовой долей
кислоты 60% и плотностью 1,5 г/см3
1. Вычислить
объем оксида серы (IV),
который образуется при разложении сульфита кальция массой 300г с массовой долей
примесей 10%.
2. Определить
молярную концентрацию раствора серной кислоты, которая образовалась при
смешивании 50мл раствора серной кислоты с 450мл воды.
Д/З
1 вариант
1.
Написать
уравнения реакций, с помощью которых можно осуществить следующие
преобразования:
H2S ---- S ------ SO2 ---- Na2SO3
------ SO2
2 вариант
1.
Написать
уравнения реакций, с помощью которых можно осуществить следующие преобразования:
S ------ SO2 ---- SO3 ----- H2SO4 ------ H2SO3 ----- SO2
15.12 Урок проводится в очном режиме
11.12 Сероводородная и сернистая кислоты и их соли.
Здравствуйте ребята.
Продолжаем знакомиться с характеристикой соединений серы.
Запишите в тетради число и тему урока. Поработайте с материалом п. 20,21 (стр. 69,72) и запишите две блок-схемы по характеристике сероводородной и сернистой кислот. При необходимости используйте интернет ресурсы.
Д/з решить №3 стр 70
08.12 Урок проводится в очном режиме
04.12 Подгруппа кислорода
Здравствуйте ребята.
Пройдите обязательный тест по ССЫЛКЕ Ответ отправить до 20.00 05.12
Начинаем изучение новой подгруппы неметаллов
Сегодня на уроке работаем с материалом учебника
Общая характеристика подгруппы кислорода. Аллотропные модификации кислорода и серы
Откройте п.17, найдите ответы на вопросы № 1, 3 стр. 64. Запишите ответы в тетрадь.
Вспомните аллотропные модификации кислорода. Назовите аллотропные модификации серы.
Свойства серы.
Запишите физические свойства серы ( параграф 18)
Письменно выполните задания № 1,2 с.67
д/з Решите задачу №4 с.64
20.11 Общая характеристика галогенов. Хлор.Хлороводород
Здравствуйте ребята. Запишите тему сегодняшнего урока. Начнем урок с просмотра видео-презентации ССЫЛКА
Составьте на основании данного материала опорный конспект и запишите в тетрадь
Откройте п. 13. Прочтите.
Выпишите уравнения реакций, подтверждающие химические свойства хлора.
Откройте в учебнике стр.55 . Ответьте письменно на вопрос №1
Хлороводородная кислота и ее соли
Посмотрите видеоурок ССЫЛКА
Запишите свойства НСL. Обратите внимание на качественную реакцию.
Д/З Ответьте на вопрос Как определить ионы галогенов? Советую вам найти в интернете видеоопыты по данному вопросу
17.11 Урок проводится в очном режиме
13.11 Реакции обмена между растворами электролитов. Ионные уравнения
Здравствуйте ребята!
Начинаем наш урок с просмотра видеоурока по данной теме. Внимательно слушайте объяснение учителя, запишите в тетради сегодняшнее число, тему урока и все примеры уравнений по ходу изложения материала (Задания учителя в видео выполнять не нужно).
Видеоурок ссылка
Задания для закрепления пройденного материала
Допишите уравнения возможных реакций, напишите полные и сокращенные ионные уравнения этих реакций. В каждом случае назовите признак реакции, по которому можно судить о возможности ее протекания
BaCl2 + MgSO4 =
NaNO3 + MgCl2 =
азотная кислота + гидроксид калия =
карбонат калия + серная кислота =
Проверим как вы справились 17.11
10.11 Урок проводится в очном режиме
06.11
Здравствуйте ребята!
На сегодняшнем уроке мы продолжим изучение темы
«Электролитическая диссоциация».
Тема нашего урока: «Электролитическая диссоциация кислот, щелочей и солей в водных
растворах»
Откройте ваши конспекты за 03.11 и внимательно посмотрите видеофрагмент
ссылка с объяснением материала сегодняшнего урока.
Дополните ваш конспект новым материалом.
Ответьте письменно на вопросы тестов с. 29
Д/З выучить конспект, пройти тест здесь
03.11 Урок проводится в очном режиме










Комментариев нет:
Отправить комментарий