2022-2023 учебный год
06.09
Тема урока: Важнейшие химические понятия. Законы химии
Здравствуйте ребята. Поздравляю вас с началом учебного года.
Продолжаем изучение предмета химия.
Начнем с повторения основных понятий и законов.
Для работы на уроках вам понадобится рабочая тетрадь в клетку на 24 или 36 листов. Запишите число и тему урока. Требования по ведению тетради остаются такие же как в прошлом году.
Изучите теоретический блок. Повторите материал прошлых лет.
Понятие «вещество»
Вещество – это то, из чего состоят физические тела.
Физические тела– это те предметы, которые нас окружают.
Вещество отвечает на вопрос: из чего состоит?
Понятие «атом»
Атом — это наименьшая частица химического элемента, сохраняющая все его
химические свойства.
Понятие «молекула»
Молекула - это
наименьшая частица вещества, определяющая его свойства и способная к
самостоятельному существованию. Молекулы построены из атомов.
Химический элемент — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке.
Аллотропия -
существование двух и более простых
веществ одного и того же химического
элемента, различных по строению и свойствам —
так называемых аллотропных (или аллотропических) модификаций или форм.
Причины
аллотропии:
1)
Разное
количество атомов в молекуле (кислород O2 и озон O3)
2)
Разные
кристаллические решетки (алмаз и графит)
Классификация веществ (найдите информацию в учебнике п.1)
Понятия «качественный состав» и «количественный состав»
Качественный
состав вещества показывает, из атомов
каких элементов оно состоит.
Количественный
состав вещества- число
атомов каждого элемента в составе мельчайшей частицы вещества.
Символ химического элемента
Символы химических элементов—
условное обозначение химических элементов.
Знак химического элемента
Современные символы химических элементов
состоят из первой буквы или из первой и одной из следующих букв латинского
названия элементов.
Химическая формула
Химическая формула — условное обозначение химического состава и структуры веществ с помощью
символов химических элементов, числовых и вспомогательных
знаков (скобок, тире и т. п.).
Понятие «валентность»
Валентность– это способность атомов
присоединять к себе определенное число других атомов.
Относительная атомная масса
Относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных
единицах массы. Определяется как отношение массы
атома данного элемента к 1⁄12 массы нейтрального атома изотопа углерода 12C.
Значение Ar находится в клетке химического элемента в ПСЧХЭ и записано в виде
десятичной дроби.
Относительная молекулярная масса
Относительная молекулярная масса равна
сумме относительных атомных масс входящих в нее атомов.
Mr (H2O)= 2 Ar(H)+Ar(O)=2*1+16=18
Количество вещества — физическая величина,
характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых
состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).
Моль – это единица измерения количества вещества в Международной
системе единиц (СИ).
17 Молярная масса
M=Mr* 1г/моль
Постоянная Авогадро
Число́ Авогадро, конста́нта Авогадро, постоянная
Авогадро— физическая величина, численно равная количеству специфицированных структурных
единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле
вещества. Определяется как количество атомов в 12 граммах (точно) чистого
изотопа углерода-12. Обозначается обычно как NA, а иногда и L .
NA = 6,022 141 29(27)·1023 моль−1.
Закон сохранения массы вещества
Масса
веществ,
вступающих в реакцию, равна массе веществ, образующихся в
результате реакции.
Впервые закон сохранения массы сформулировал русский ученый
Ломоносов, в 1748 году, а экспериментально подтвердил его на примере обжигания
металлов в запаянных сосудах в 1756 году.
Закон постоянства состава вещества
Закон постоянства состава (Ж. Л.
Пруст, 1801—1808гг.) — любое
определенное химически чистое соединение, независимо от способа его получения,
состоит из одних и тех же химических
элементов, причём отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
закон Авогадро
Закон Авогадро: в равных объемах газов (V) при одинаковых
условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Следствия из закона Авогадро
Первое следствие из закона Авогадро:
один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm.
молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Домашнее задание: изучить параграф 1,2 выполнить письменно № 3,4 стр.9
2021-2022 учебный год
2 семестр
10.05
Решение задач
Здравствуйте ребята.
Запишите число и решите предложенные задачи
1. При взаимодействии 23 г натрия с водой было получено 10 л водорода (н. у.). Сколько это составляет процентов от теоретически возможного?
2. При взаимодействии 23 г натрия, содержащего 10% примесей,с водой было получено 10 л водорода (н. у.). Сколько это составляет процентов от теоретически возможного? Какое количество щелочи образовалось при этом?
3. Какой объем углекислого газа пропустили через «известковую воду», если при этом выпало 15 г осадка, что составляет 75% от теоретически возможного?
4. При взаимодействии 46 г натрия, содержащего 15% примесей,с водой было получено 9 л водорода (н. у.). Сколько это составляет процентов от теоретически возможного? Какое количество щелочи образовалось при этом?
12.04
Тема урока: Оксиды неметаллов и кислородсодержащие соединения. Водородные соединения неметаллов.
Здравствуйте ребята. Запишите число и тему урока.
Поработайте с теоретическим материалом. Составьте опорный конспект в произвольной форме.
Обратите внимание на домашнее задание. Вы его должны выполнить сегодня.
Оксиды неметаллов делят на несолеобразующие и солеобразующие. К несолеобразующим относят оксид кремния два, оксид азота один, оксид азота два, оксид углерода два.
Все остальные оксиды являются солеобразующими. Например, оксид фосфора пять, оксид хлора семь, оксид серы шесть, оксид серы четыре. Эти солеобразующие оксиды являются кислотными.
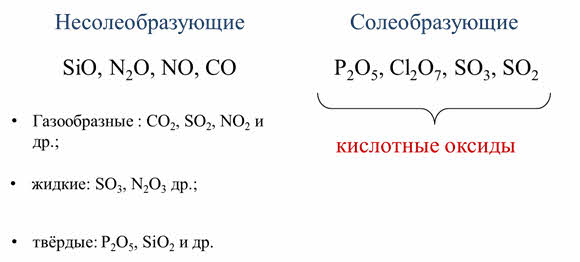
Среди них есть газообразные, как оксид углерода четыре, оксид серы четыре, оксид азота четыре и другие, а также жидкие, как оксид серы шесть, оксид азота три и другие; твёрдые, как оксид фосфора пять, оксид кремния четыре и другие.
Все кислотные оксиды – это ангидриды кислот. Например, оксид углерода четыре – ангидрид угольной кислоты, оксид фосфора пять – ангидрид фосфорной кислоты.
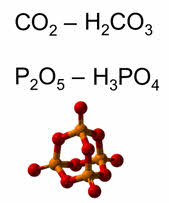
Все кислотные оксиды, кроме оксида кремния четыре, растворяются в воде с образованием гидроксидов, которые по характеру являются кислотами. При растворении оксида фосфора пять в воде образуется фосфорная кислота.
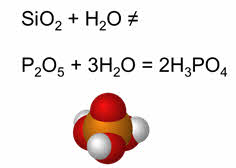
В оксидах неметаллов элемент-неметалл имеет положительные степени окисления, причём этих степеней окисления может быть несколько и тогда неметалл может образовывать несколько оксидов.
Например, сера в степени окисления плюс четыре образует оксид серы четыре, в степени окисления плюс шесть – оксид серы шесть, азот также имеет несколько степеней окисления.
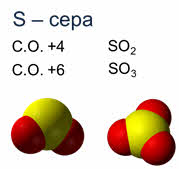
Так, азот в степени окисления плюс один образует оксид азота один, азот в степени окисления плюс два образует оксид азота два, азот в степени окисления плюс три – оксид азота три, в степени окисления плюс четыре – оксид азота четыре, в степени окисления плюс пять – оксид азота пять.

Чем выше степень окисления элемента-неметалла в оксиде, тем сильнее кислотный характер оксида. Так кислотные свойства оксида серы шесть выражены сильнее, чем оксида серы четыре.
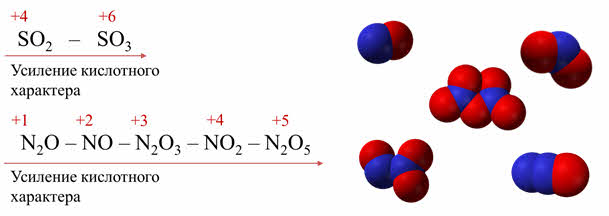
Тоже самое наблюдается в ряду оксидов азота: начиная с оксида азота один до оксида азота пять идёт усиление кислотных свойств оксидов, так как увеличивается степень окисления элемента-неметалла.
Оксиды неметаллов – это соединения с полярной ковалентной связью. Кристаллические решётки у этих оксидов могут быть молекулярные, как у оксида углерода четыре, оксида серы шесть, и атомные, как у оксида кремния четыре.
По периоду слева направо усиливается кислотный характер оксида. Так у оксида серы шесть кислотные свойства выражены сильнее, чем у оксида кремния четыре, так как по периоду также увеличивается высшая степень окисления элементов-неметаллов в соединениях.
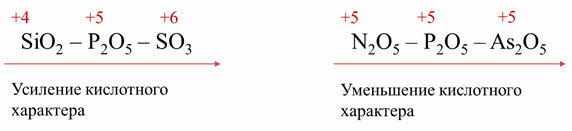
В группах главных подгруппах сверху вниз кислотный характер оксидов ослабевает, поэтому в пятой A группе кислотные свойства оксида азота пять будут выражены сильнее, чем у оксида мышьяка пять. Так как в группе сверху вниз увеличивается радиус иона неметалла, но степень окисления не изменяется.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и его радиуса атома.
Оксидам неметаллов соответствуют гидроксиды – кислородсодержащие кислоты. Изменение силы кислоты зависит от степени окисления неметалла, радиуса атома.
Например, оксидам азота три и пять соответствуют кислоты – азотистая и азотная. Азотная кислота является более сильной, чем азотистая и-за того, что в азотной кислоте степень окисления азота плюс пять, а в азотистой плюс три.
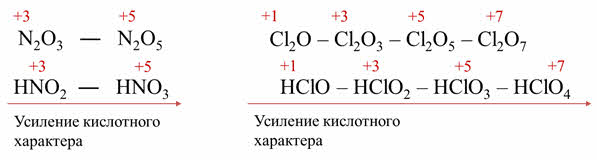
Кислотные свойства оксидов хлора также усиливаются с увеличение степени окисления атома хлора, поэтому и сила кислоты, которой соответствует данный оксид, также будет увеличиваться. Поэтому в ряду от хлорноватистой до хлорной кислоты идёт увеличение силы кислоты.
Таким образом, в периодах слева направо идёт увеличение заряда ядра атома неметалла, поэтому наблюдается усиление кислотных свойств гидроксидов, образованных оксидами неметаллов.

Например, хлорная кислота является более сильной, чем кремниевая, потому что степень окисления хлора в хлорной кислоте плюс семь, а кремния в кремниевой кислоте плюс четыре, а радиус иона неметалла уменьшается от кремниевой до хлорной кислоты.
В группах сверху вниз кислотный характер гидроксидов, образованных оксидами неметаллов, ослабевает. Например, серная кислота является более сильной, чем тэллуровая, так как радиус иона неметалла в этом ряду возрастает, а степень окисления неметалла не изменяется, и остаётся плюс шесть.

Все оксиды и гидроксиды, образованные элементами в максимальной степени окисления всегда окислители. Так, в реакции оксида серы шесть с сероводородом сера в степени окисления плюс шесть понижает свою степень окисления до плюс четырёх, поэтому оксид серы шесть выступает в роли окислителя, в реакции серной кислоты с медью, серная кислота также является окислителем, потому что сера понижает свою степень окисления с плюс шести до плюс четырёх.
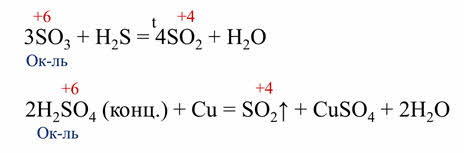
Если же в оксиде или гидроксиде элемент-неметалл проявляет промежуточную степень окисления, то эти соединения могут быть и окислителями, и восстановителями.
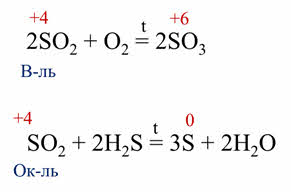
Так, в реакции оксида серы четыре с кислородом образуется оксид серы шесть. Оксид серы четыре в данной реакции является восстановителем, так как сера повышает свою степень окисления с плюс четырёх до плюс шести. В реакции оксида серы четыре с сероводородом, образуется сера и вода. В этой реакции оксид серы четыре является окислителем, так как сера понижает свою степень окисления с плюс четырёх до нуля.
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстро испаряются.
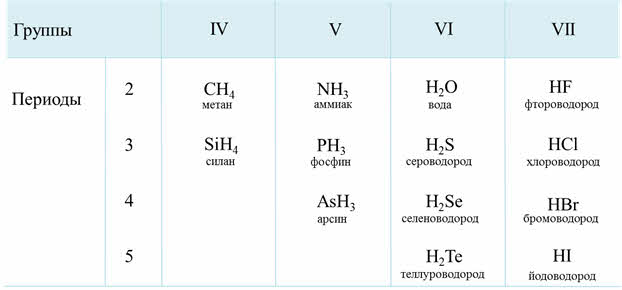
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотэрные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
Так, углероду соответствует водородное соединение цэ-аш-четыре – метан, кремнию – силан, азоту – аммиак, фосфору – фосфин, мышьяку – арсин, кислороду – вода, сере – сероводород, селену – селеноводород, тэллуру – тэллуроводород, фтору – фтороводород, хлору – хлороводород, брому – бромоводород, йоду – йодоводород.
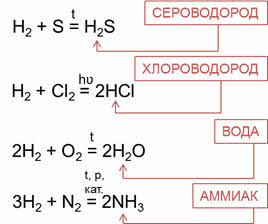
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
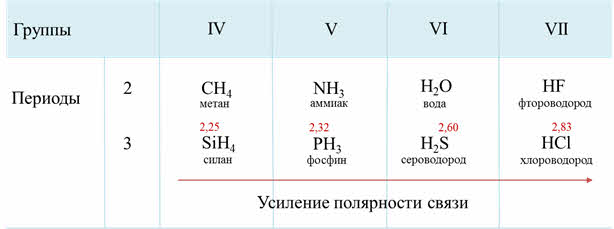
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
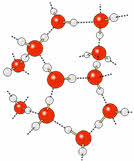
Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
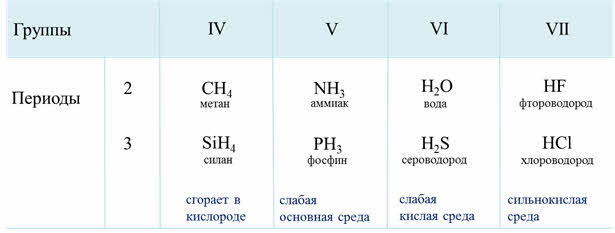
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
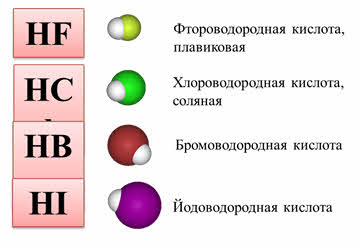
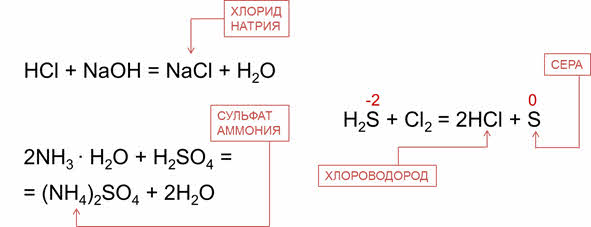
Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Домашнее задание: пройдите тест ССЫЛКА (время ограничено)
22.03
Тема урока: Обзор металлов А-групп периодической системы химических элементов. Обзор металлов Б-групп периодической системы химических элементов. Сплавы
Здравствуйте ребята. Запишите в тетради число и тему урока.
Запишите опорный конспект на основании теоретического материала
1.Металлы А-групп
Металлы 1 главной подгруппы называются щелочными –образуют щелочи, 2 группы – щелочно-земельными, из 3 группы изучаем свойства одного из широко применяемых в технике металлов – алюминия.
Атомы щелочных металлов содержат на внешнем энергетическом уровне только 1 электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильными восстановителями.
Строение атома лития и натрия:


Следующие за щелочными металлами элементы составляют главную подгруппу II группы, также являются типичными металлами, обладающими сильной восстановительной способностью. Са, Sr, Ba, Ra – щелочноземельные металлы.

К металлам относятся и элементы главной подгруппы III группы, исключая бор.

Из элементов главных подгрупп следующих групп к металлам относят:
в IV группе – германий, олово, свинец;
в V группе – сурьма и висмут;
в VI группе – полоний.
Элементы побочных подгрупп – все металлы.
2.Химические свойства металлов.
Зная строение металлов, можно предвидеть их общие химические свойства.
В атомах металлов на внешней электронной оболочке находятся электроны, которые легко отрываются от атомов.
Наиболее общим химическим свойством металлов является способность их атомов при химических реакциях отдавать валентные электроны и превращаться в положительно заряженные ионы, т.е. металлы в реакциях являются сильными восстановителями.
2.1.Взаимодействие с простыми веществами: кислородом, галогенами, серой, азотом, водородом.
Реакции с кислородом.
4 Nа + O2 → 2 Nа2O; (побочный продукт)
Взаимодействие с галогенами.
2К + Cl2 →2 КCl;
Взаимодействие с серой.
2K + S → K2 S;
Са + S → СаS;
Взаимодействие с азотом.
6К + N2 → 2K 3 N;
Взаимодействие с водородом (щелочные металлы).
2К + Н2 → 2КН
Обратите внимание, что в этих реакциях атомы металлов отдают электроны, т.е. являются восстановителями, а неметаллы принимают электроны, т.е. являются окислителями.
Вывод: Запомните, металлы реагируют с галогенами, кислородом, серой, азотом, водородом, образуя соединения ……иды. В реакциях с неметаллами металлы являются восстановителями.
Давайте теперь рассмотрим с вами взаимодействие металлов со сложными веществами.
2.2. Взаимодействие со сложными веществами.
2.2.1.Взаимодействие металлов с водой.
При каких условиях металлы вступают в реакцию с водой? (При обычной температуре и при нагревании).
Что образуется при взаимодействии воды с активными металлами при обычной температуре? (Образуется гидроксид и выделяется водород).
Обсуждаем, какой металл реагирует более активно с водой? Почему? С чем это связано? (Положение в ПСХЭ, чем больше радиус, тем активнее металл).
2Na + H2O → 2NaOH + H2 ↑.
Ca + 2H2O → Ca(OH)2 + H2 ↑.
Как вы думаете, почему натрий более активно взаимодействует с водой, чем кальций? (Натрий более активный металл, чем кальций. Он легко отдает свои валентные электроны, является самым сильным восстановителем).
При взаимодействии воды с менее активными металлами образуются оксиды металлов и выделяется водород. Это металлы, стоящие в ряду напряжений после алюминия. Составляем уравнение реакции взаимодействия цинка с водой.
Zn + H2O → ZnO + H2 ↑;
Скажите пожалуйста, все ли металлы взаимодействуют с водой? (Нет).
Совершенно верно. А почему? (см. электрохимический ряд напряжения).
Скажите, а будет ли золото взаимодействовать с водой? (Нет).
Почему? (В ЭХ ряду после водорода) .Медь, ртуть, серебро, платина, золото с водой не реагируют!
Au + H2O → реакция не идет
Запомните! Металлы, стоящие в электрохимическом ряду напряжений до алюминия (включительно) образуют с водой гидроксиды, от алюминия до свинца – оксиды. Остальные с водой не реагируют.
2.2.2. Взаимодействие металлов с растворами кислот.
Мg + 2HCl → Мg Cl2 + H2 ↑;
Запомните! Металлы стоящие в электрохимическом ряду напряжений до водорода могут вытеснять водород из растворов кислот. Металлы стоящие в электрохимическом ряду напряжений после водорода не могут вытеснять водород из растворов кислот.
Cu + H2SO4 → не реагирует.
Какой же вывод можно сделать из этого? С помощью преподавателя находят правильные ответы на поставленные вопросы, делают выводы.
Итак, ряд поправок:
1. правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
2. концентрированная серная кислота и азотная кислота любой концентрации реагируют с металлами по особому, при этом водород не образуется;
3. на щелочные металлы правило не распространяется, т.к. они легко взаимодействуют с водой.
Вывод: из уравнений реакций видно, что в них окислителями являются ионы водорода и ионы неметаллов, а атомы металлов – восстановители.
2.2.3. Взаимодействие металлов с растворами солей.
Показываем, какие металлы вытесняют из солей по ряду напряжений металлов.
Fe + CuSO4 → Cu + FeSO4
Запомните! В электрохимическом ряду напряжений металл, стоящий левее, может вытеснять из растворов солей металл, стоящий правее (записываем в тетрадь).
Исключение: металлы до магния не могут вытеснять другие металлы из растворов солей, так как в первую очередь реагируют с водой, образуя щелочи.
3.Свойства алюминия: .
Взаимодействие с кислородом.
4Al + 3O2 → 2Al2O3; (при нагревании)
Взаимодействие с галогенами.
2Al + 3Br2 → 2AlBr3; (при нагревании)
Взаимодействие с серой.
2 Al + 3S = Al 2S3 (при нагревании)
Взаимодействие с азотом
2 Al + N2 = 2Al N (при нагревании)
С водородом непосредственно не реагирует.
Поскольку алюминий проявляет амфотерные свойства, то он реагирует и с кислотами и с щелочами, образуя соли. Является активным металлом, поэтому также реагирует и с водой. Почему в быту алюминий не проявляет свойства активного металла?» (поверхность алюминия покрыта оксидной пленкой)
Запишите общие закономерности, проявляющиеся у
металлических элементов Б – групп.
1. Химическая активность металлических элементов Б –
групп в группах уменьшается сверху вниз.
2. У d-элементов III-VII групп
максимальная положительная степень окисления совпадает с номером группы.
Например, у Cr высшая степень окисления +6, у Mn - +7, что совпадает с номером
группы.
3.Некоторые d-элементы VIII Б - группы,
например, Ru и Os, также образуют соединения, в которых максимальная
степень окисления равна +8, т.е. соответствует номеру группы.
4.С увеличением степени окисления атомов металлов Б -
групп основные свойства их оксидов и гидроксидов уменьшаются, а кислотные –
увеличиваются. Например, CrO – основной оксид, Cr2O3 –
амфотерный оксид, CrO3 – кислотный оксид.
Из металлов Б – групп наибольшее
практическое значение имеют Cu, Zn, Ti, Cr, Fe.
Для закрепления материала посмотрите видеофрагмент ССЫЛКА
Пройдите тест по ССЫЛКА до 17.00 22.03
Домашнее задание: Сравнительная характеристика Cu, Cr, Fe.
Используя материал § 29, 31,32 учебника, составить таблицу (4 колонки) «Сравнительная характеристика Cu, Cr, Fе» по плану (для первой колонки)
1.Положение элемента в ПСХЭ, строение атома, возможные
степени окисления
2.Нахождение в природе
3.Получение
4.Физические свойства
5.Химические свойства
6.Применение
Задания в тетради выполнить до 24.03
15.03
Тема урока: Общие способы получения металлов. Электролиз. Коррозия.
Здравствуйте ребята. Запишите в тетради число и тему урока.
Рассмотрим теоретический материал ССЫЛКА
Запишите в тетрадь примеры способов получения металлов, подтвердите уравнениями реакций.
Прочтите параграф 25. Выполните письменно №1 стр. 118
Посмотрите видеофрагмент ССЫЛКА . Выполните письменно № 2 стр. 112
Задание выполнить до 18.03
04.02
Здравствуйте ребята. Запишите в тетради тему урока. Прочтите теоретический материал по ссылке. Запишите опорные конспекты. Для закрепления материала пройдите тест, ссылка ниже. Ответы отправьте до 8.02.
Общая характеристика металлов.
Теоретический материал к опорным конспектам ССЫЛКА
ссылка на тест.
1 семестр
09.11
Тема: Типы химической связи
Добрый день! Продолжаем рассматривать вопросы темы "Строение вещества". Начнем с повторения материала по характеристике химической связи.
Предлагаю вам посмотреть видеоурок ссылка
Используя материал видеоурока, запишите в тетрадь ответы на вопросы:
1. Назовите причину и условие образования химической связи.
2. Какие электроны принимают участие в образовании химической связи?
3. Составьте схему классификации типов химических связей.
4. Запишите механизмы образования типов связей в молекулах хлора, аммиака
5. Перечислите свойства химической связи
Домашнее задание: проработайте п. 7, 8
2020-2021 учебный год
11 А класс
ССЫЛКА на тест. Выполнить до 18.00 25.04
11-Б класс
ссылка на тест.
11 Б класс
Общая характеристика металлов.
Теоретический материал к опорным конспектам ССЫЛКА
11А класс
Обзор неметаллов. Свойства и применение важнейших неметаллов.
Видеоурок ССылка
11А класс
ПОДГОТОВКА К КОНТРОЛЬНОЙ РАБОТЕ
Ребята, в контрольной работе будет 5 заданий и 4 варианта.
задание 1 - Составить электронную формулу атома, предложенного металла
задание 2 - Составьте уравнение взаимодействия металла Х с разбавленной или концентрированной У кислотой с помощью электронного баланса
задание 3 - Осуществить цепочку превращений: например
марганец → хлорид марганца (2) → гидроксид
марганца (2) → оксид марганца (4) → манганат калия
4 и 5 задания - решить задачи
1.
При взаимодействии 23 г
натрия с водой было получено 10 л водорода (н. у.). Сколько это составляет
процентов от теоретически возможного?
2.
При взаимодействии 23 г
натрия, содержащего 10% примесей,с водой было получено 10 л водорода (н. у.).
Сколько это составляет процентов от теоретически
возможного? Какое количество щелочи образовалось при этом?
3. Какой объем углекислого газа
пропустили через «известковую
воду», если при этом выпало 15 г осадка, что составляет 75% от теоретически
возможного?
4. При взаимодействии 46 г натрия, содержащего
15% примесей,с водой было получено 9 л водорода (н. у.). Сколько это составляет
процентов от теоретически возможного? Какое
количество щелочи образовалось при
этом?
5. При взаимодействии 39 г калия с водой было
получено 20 л водорода (н. у.). Сколько это составляет процентов от теоретически возможного?
6.
Какой
объем углекислого газа пропустили через «известковую воду», если при этом выпало 15 г осадка, что
составляет 75% от теоретически возможного? Какое
количество гидроксида кальция
вступило при этом в реакцию? Сколько
граммов 2%-ного раствора гидроксида кальция потребовалось для реакции?
7. Какой объем водорода
выделится при взаимодействии 450 г. натрия с водой, если выход составляет 80% от теоретически возможного?
8. При взаимодействии 2,3 г натрия с водой было
получено 3 л водорода (н. у.). Сколько это составляет процентов от теоретически возможного? Какое количество щелочи
образовалось при этом?
10.03 11б
Оксиды углерода. Угольная кислота и ее соли
Повторите материал прошлого урока по опорному конспекту
Перейдите по ССЫЛКЕ на страницу, где представлен теоретический материал по данной теме.
Посмотрите все опыты, выполните задания для закрепления
10.02 11б
Оксиды серы
Здравствуйте ребята. Повторим материал прошлого урока (видео до 3 минуты 17 секунд). ССЫЛКА
Продолжим просмотр видеофрагмента. Запишите характеристику оксидов серы и окислительно-восстановительные возможности соединений серы
Выполните задание
1.Оксид серы (IV) реагирует с каждым из двух веществ, формулы которых:
а) Na2SO4 и MgO б) Ca(OH)2 и NO в) H2S и CaO г) H2O и CO2
Напишите уравнения для этой пары веществ. Для ОВР составьте схему электронного баланса и укажите роль оксида серы (IV) в этой реакции
2. Составьте уравнения следующих превращений: S → SO2 → K2SO3 → SO2
Для реакции 3 напишите молекулярное и ионно-молекулярное уравнения и укажите тип реакции.
3.Рассчитайте максимальный объем оксида серы (IV) (н.у.), который может быть поглощен 500 г раствора с массовой долей гидроксида натрия 10%.
25.01 11-Б
Решение расчетных задач
Здравствуйте ребята
Выполните письменную работу на двойных листочках в клетку. Работы сдать в четверг на очном уроке или во вторник 26.01 в 41 кабинет
Вариант I (нечетные по списку в журнале)
1. Жидким
галогеном является
1) хлор
2) фтор
3) бром
4) иод
2. Составьте схему
строения атома хлора. Укажите общее число и число неспаренных электронов.
Запишите формулы типичных соединений.
3. Наиболее сильный
окислитель — это
1) хлор
2) бром
3) фтор
4) иод
4. Составьте
уравнение реакции, расставьте коэффициенты с помощью электронного баланса.
Укажите окислитель и восстановитель.
KВr + Сl2 = KСl + Вr2
5. Степень окисления хлора в хлорной кислоте HClO4
1) +5
2) +1
3) –1
4) +7
5) 0
6. Составьте два
уравнения реакций: а) соединения; б) замещения, в
которых участвуют галогены.
7. Наиболее прочная
галогеноводородная кислота — это
1) НСl
2) НВr
3) HI 4) HF
8. С
какими из перечисленных веществ будет реагировать соляная кислота: ртуть, оксид
меди(II), алюминий, гидроксид калия, карбонат калия? Напишите уравнения
возможных реакций.
9. Вычислите объемы хлора и водорода
(н. у.), необходимых для получения
10. Какая масса йодида калия была окислена оксидом ксенона (IV) в соляной кислоте, если при этом образовалось 2,62 г ксенона?
Вариант II (четные по списку)
1. Галоген,
представляющий собой твердое вещество, — это
1) фтор
2) хлор
3) бром
4) иод
2. Составьте схему
строения атома фтора. Укажите общее число электронов, вращающихся вокруг ядра
атома, и число электронов, находящихся на наружном электронном слое.
3. Галоген, который
способен возгоняться, — это
1) фтор
2) хлор
3) бром
4) иод
4. Расставьте
коэффициенты в схеме реакции с помощью электронного баланса. Укажите, какое
вещество окисляется, какое восстанавливается.
MnO2 + HCl = Сl2 + МnCl2 + Н2О
5. Степень окисления
хлора в бертолетовой соли KСlO3
1) –1
2) +1
3) +5
4) +7
5) 0
6. Составьте два
уравнения реакций, в которых один галоген вытесняет другой из соли.
7. Различить
галогеноводородные кислоты и их соли можно с помощью одного реактива
1) хлорной
воды
2) AgNO3
3) крахмального клейстера 4) Cu
8. С какими из
перечисленных веществ будет реагировать соляная кислота: ртуть, оксид меди(II),
алюминий, гидроксид калия, карбонат калия? Напишите уравнения возможных
реакций.
9. Для реакции взяли
10. Растворимость брома в воде при 200С равна 3,20 г на 100 г воды. Какую массу бромной воды следует взять для полного вытеснения йода из йодида лития, находящегося в 200 г 2,68%-го раствора?
22.01 11-А класс
Водородный показатель (pH) раствора. Реакции ионного обмена.
Здравствуйте ребята.
Запишите тему урока. Посмотрите видеофрагмент ССЫЛКА
Запишите в тетради конспект на основании объяснения учителя.
Продолжаем повторение материала. Внимательно слушайте объяснение учителя, запишите в тетради все примеры уравнений по ходу изложения материала (Задания учителя в видео выполнять не нужно).
Видеоурок ссылка
Задания для закрепления пройденного материала
Допишите уравнения возможных реакций, напишите полные и сокращенные ионные уравнения этих реакций. В каждом случае назовите признак реакции, по которому можно судить о возможности ее протекания
BaCl2 + MgSO4 =
NaNO3 + MgCl2 =
азотная кислота + гидроксид калия =
карбонат калия + серная кислота =
22.01 11-Б класс
Кислородсодержащие кислоты хлора
Здравствуйте ребята
Перейдите по ССЫЛКЕ на страницу, где представлен теоретический материал по данной теме.
Составьте сводную таблицу, характеризующую свойства данных кислот.
Пройдите тест для закрепления материала ссылка
21.01 11-Б класс Урок проводится в очном режиме
Пр. раб. № 2. Химические свойства соляной кислоты
18.01 11-Б класс
Общая характеристика галогенов. Особенности химии фтора. Галогеноводороды
Повторите материал 9 - го класса. Пройдите по ССЫЛКЕ.
Запишите в конспект таблицу в данной ссылке. Сравните свойства галогенов.
Запишите особенности фтора, используя изображения и интернет ресурсы.
Сравнительная характеристика галогенводородов ССЫЛКА, запишите в удобном для вас виде - таблица, схема и т. п.
Домашнее задание: выучить теоретический материал
21.12 11Б
Электролиз растворов и расплавов. Законы Фарадея.
Здравствуйте ребята. Запишите число и тему урока. Используя теоретический материал, запишите конспект урока.
Электролиз – совокупность
процессов, происходящих при прохождении электрического тока
через электрохимическую систему, состоящую из двух электродов и
расплава или раствора электролита.
Для осуществления
электролиза к отрицательному полюсу
внешнего источника тока присоединяют
катод, а к положительному
– анод
и погружают их в
электролит. При прохождении
тока через электролит катионы под действием
электрического поля движутся к катоду, а анионы – положительному электроду –
аноду. Например, при
электролизе расплава MgCl2
катионы магния, подойдя к катоду, взаимодействуют с приходящими по внешней цепи
электронами, восстанавливаются:
К «-» Mg2+ + 2е- → Mg.
Анионы
хлора перемещаются к положительному электроду и, отдавая избыточные электроны,
окисляются. При этом
первичным процессом является
окисление ионов хлора:
А «+» 2Cl- – 2е-> 2Cl0
,
а вторичным
– связывание образующихся
атомов хлора в молекулы
2Cl → Cl2.
Складывая уравнения
электродных процессов, получим
суммарное уравнение
окислительно-восстановительной
реакции, протекающей при электролизе расплава MgCl2:
Mg2+ + 2Cl- → Mg + Cl2.
Эта
реакция не может
протекать самопроизвольно, энергия необходимая для ее осуществления, поступает от внешнего
источника тока. В ходе этой реакции
электрическая энергия превращается в химическую.
Другими
словами электролиз включает два процесса: миграцию реагирующих частиц под
действием электрического поля к поверхности электрода и переход заряда с
частицы на электрод или с электрода на частицу. Миграция ионов определяется их
подвижностью и числами переноса.
Процесс переноса нескольких электрических зарядов осуществляется, как правило,
в виде последовательности одноэлектродных реакций, т.е. постадийно, с
образованием промежуточных частиц (ионов или радикалов), которые некоторое
время могут существовать на электроде в адсорбированном
состоянии.
Скорости
электродных реакций зависят от состава и концентрации
электролита, материала электродов, электродного
потенциала, температуры и гидродинамических
условий. Мерой скорости служит плотность тока – это количество переносимых
электрических зарядов через единицу площади поверхности электрода в единицу
времени.
При рассмотрении
электролиза водных растворов
необходимо помнить, что кроме ионов электролита во всяком водном
растворе есть еще ионы Н+ и
ОН- - продукты диссоциации
воды. В электрическом поле ионы Н+ перемещаются к катоду, а ионы ОН- к аноду. Таким образом, у катода могут
разряжаться как катионы
электролита, так и
катионы водорода. У
анода может происходить разряд
как анионов электролита,
так и гидроксид ионов. Кроме
того, молекулы воды
также могут подвергаться электрохимическому окислению
или восстановлению. Из нескольких
возможных процессов будет
протекать тот, осуществление
которого сопряжено с минимальными затратами энергии.
Рассмотрим последовательность разряда
ионов при электролизе водных растворов электролитов.
Рассмотрим электролиз
раствора сульфата калия
с графитовыми электродами:
K2SO4 → 2K+ + SO4 2-
(H2O)
«–» Катод← К+ SO42-
→ Анод «+»
H2O H2O
φ0K+ / K = -2,925В <φ0Al+ / Al , следовательно, ионы К+ относятся 1-ой группе катионов и на катоде
происходит выделение водорода:
К «-»
4Н2О +4е-→
4Н0 + 4ОН- – первичный процесс;
4Н → 2Н2 – вторичный процесс.
Анод из
графита окислению не
подвергаются. В растворе присутствуют ионы SO42- , которые
также не будут
подвергаться электрохимическому окислению. Происходит выделение
кислорода:
А «+»
2Н2О – 4е-
→ 4Н+ – 2О- – первичный процесс;
2О → О2 – вторичный
процесс.
На катоде
выделится водород, а на аноде –
кислород, следовательно
происходит электрохимическое разложение воды. Вблизи катода
образуется гидроксид калия,
а вблизи анода –
серная кислота.
Примеры электролиза
- водного раствора хлорида меди
а) уравнения электролитической диссоциации (образование ионов в растворе):
CuCl2 <=> Cu2+ + 2Cl–
H2O = H+ + ОН–
б) восстановительные процессы на катоде (К–):
Cu2+ + 2e– = Cu0
в) окислительные процессы на аноде (А+):
2Сl– – 2e– = 2Cl0
г) суммарное уравнение электролиза:
CuCl2 + H2O = Сu + Cl2 + H2O
CuCl2 <=> Сu2+ + 2Cl–
Из описанного выше видно, что прохождение электрического тока через электролиты сопровождается химическими превращениями вещества и выделением газообразного хлора на аноде и чистой меди – на катоде.
3) составим уравнение электролиза водного раствора сульфата меди.
CuSO4 <=>
Cu2+ + SO2–4
H2O <=> H+ + ОН–
б) К(–): Cu2+ + 2e– = Cuo (восстановление)
| 2
в) A(+): 4ОН– – 4e– = O2 + 2H2O (окисление) |
1
Суммарное уравнение электролиза:
г)
2Cu SO4 + 2H2O = 2Сu + O2 + 2H2SO4
Законы электролиза
Связь между количеством выделившегося при электролизе вещества количеством прошедшего через электролит электричества выражается законами Фарадея.
Первый
закон Фарадея:
массы веществ, выделившиеся
на электродах при электролизе, прямо
пропорциональны количеству электричества прошедшего через электролит,
т.е.
m = k · I · Δt,
где m – масса
вещества, образовавшегося на электроде или у электрода, г.
k – электрохимический эквивалент
вещества;
А – молярная масса вещества;
z – валентность;
F = 96487 Кл или F = 26,8
А/ч – постоянная Фарадея;
Δt – время
проведения электролиза.
Второй закон
Фарадея
(закон эквивалентов для
электрохимических реакций):
одинаковые количества электричества
выделяют на электродах при электролизе эквивалентные
массы различных веществ:
где М – молярная масса данного вещества, образовавшегося после электролиза; I- сила тока, пропущенного через вещество или смесь веществ; Δt – время, в течении которого проводится электролиз; n –число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона, принявшего непосредственное участие в электролизе.
Отношение количества электричества (q),
необходимого для выделения данной массы вещества, ко всему количеству
прошедшего через электролит электричества (Q), называется выходом по току
данного вещества и обычно выражается в процентах:
Д\З подготовиться к контрольной работе
18.12 11Б
Химические источники тока. Гальванические и топливные элементы, аккумуляторы.
Здравствуйте ребята.
Запишите число и тему урока. Откройте учебники п.22. Прочтите материал параграфа. Ответьте письменно на вопросы 1-3 стр.102
18.12 11А
Катализ и катализаторы. Обратимость реакций. Химическое равновесие
запишите число и тему урока
запишите опорный конспект (параграф 14,15)
пройдите тест ССЫЛКА Ответ прислать сегодня до 20.00
выучить конспект
14.12 11Б
Окислительно-восстановительные реакции. Методы электронного и электронно-ионного баланса (полуреакций).
Повторите ОВР по ССЫЛКЕ
Запишите примеры ОВР из видеофрагмента ССЫЛКА
Рассмотрим метод электронно-ионного баланса.
Просмотрите объяснение учителя ССЫЛКА
Запишите примеры из видеофрагмента.
07.12 11Б
Ионное произведение воды. Водородный показатель (рН) раствора
Здравствуйте ребята. Начнем наш урок с проверки знаний по пройденным вопросам раздела. Перейдите по ссылке и отправьте мне ваши ответы сегодня до 20.00
Запишите тему урока. Откройте п.19, прочтите. Посмотрите видеофрагмент ССЫЛКА
Запишите в тетради конспект на основании объяснения учителя.
Домашнее задание: выполните тест ССЫЛКА (выполнить до 15.00 09.12)
04.12 11 Б
Произведение растворимости. Кислотно-основные взаимодействия в растворах. Амфотерность.
Посмотрите видеорок по ссылке
Запишите конспект урока
Поработайте с теоретическим материалом по ССЫЛКЕ
Составьте опорный конспект.
Выучите теоретический материал
04.12 11А класс
Классификация химических реакций в неорганической и органической химии.
Здравствуйте ребята! Сегодня мы начинаем изучение раздела "Химические реакции".
Вспомним классификацию химических реакций в органической химии. Посмотрите видеоурок. Кратко запишите типы классификации химических реакций. Для этого пройдите по ссылке
Для того, чтобы подготовиться к изучении дальнейшего материала в этом разделе, вам нужно вспомнить классификацию химических реакций в неорганической химии. Для повторения вы можете использовать конспекты за 9 класс, ваш учебник п.12 или пройти по ссылке
и послушать объяснение учителя.
Д/з п.12 выполнить №3, 9 стр. 58
30.11 11Б
Обратимость реакций. Химическое равновесие. Константа равновесия.
Посмотрите видеофрагмент ссылка
Запишите определения, формулы и пример задачи
Смещение равновесия под действием различных факторов. Принцип Ле-Шателье.
Посмотрите видеофрагмент ссылка
Запишите конспект урока.
Выполните №3 стр. 73
Пройдите по ССЫЛКА и выполните индивидуальные задания. Задачи решить до следующего урока на двойных листах.
26.11 11А и 11Б
Урок проводится в очном режиме
23.11 11Б
Здравствуйте ребята!
Запишите в тетради тему сегодняшнего урока
Скорость реакции, ее зависимость от различных факторов.
Закон действующих масс. Правило Вант-Гоффа.
Подготовьте к следующему уроку ответы на вопросы
Что такое скорость реакции?
Факторы, от которых зависит скорость химической реакции
Закон действующих масс
Правило Вант-Гоффа
Для подготовки используйте п.13 и видеофрагмент ссылка
20.11 11 А класс
Пространственное строение молекул неорганических и органических веществ.
Здравствуйте ребята. Предлагаю вам сегодня начать урок с просмотра двух видеофрагментов по следующим ССЫЛКАМ и ссылка
Теперь поработаем с учебником, откройте п.9. Внимательно прочитайте материал параграфа. Выполните задание 1, 3 стр. 43 (письменно)
Д/з п.9 № 4, 5 (письменно)
20.11 11- Б класс
Закон Гесса и следствия из него. Энергия Гиббса.
Здравствуйте ребята.
Предлагаю вам начать урок с просмотра видеоурока по данной теме ССЫЛКА
Это теоретический материал сегодняшнего урока, запишите конспект.
Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ.
Существует два
важнейших закона термохимии.
Первый из них, закон
Лавуазье-Лапласа, формулируется следующим образом: тепловой эффект
прямой реакции всегда равен тепловому эффекту обратной реакции с
противоположным знаком. (Слайды 13-16).
Второй закон
термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом:
Тепловой эффект
реакции зависит только от начального и конечного состояния веществ и не зависит
от промежуточных стадий процесса.
Например, сульфат
натрия можно получить двумя способами:
Первый путь (одностадийный):
2 NaOH + H2SO4 =
Na2SO4 + 2 H2O + 131 кДж;
Второй путь (двухстадийный):
а) NaOH + H2SO4 =
NaНSO4 + H2O + 62 кДж
б)
NaHSO4 + NaOH = Na2SO4 + H2O
+ 69 кДж
складывая тепловые
эффекты двух последовательных реакций в способе (2) мы получаем тот же тепловой эффект, что и
для способа (1): 65 кДж + 69 кДж = 131 кДж
Ученый, чьим именем
назван основной закон термохимии, несколько лет работал врачом в Иркутске; по
учебнику, написанному им, учился Дмитрий Менделеев.
По-настоящему его
звали Гесс Герман Генрих. И немудрено - родился он в многонациональной Женеве,
где говорили по-немецки столь же широко, как и на других языках. Однако вырос и
до конца своих дней прожил в России, где его величали на славянский манер -
Герман Иванович. Так что в историю науки он вошел русским ученым, хоть и с
заморской фамилией. Герман Гесс стал мировым светилом. Что примечательно, не
только благодаря острому уму, знаниям и интересу к химии, но и Сибири -
Иркутску, Байкалу. Изучая наш край, он собрал богатый фактический материал и
написал работу, представив которую в Санкт-Петербургскую академию наук, был
сразу произведен в адъюнкты и продолжил исследования по части химии при этом авторитетном
научном заведении: открыл лабораторию, проводил многочисленные опыты.
Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции.
Классическим определением энергии Гиббса является выражение
G = U + PV − TS,
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности процесса является неравенство
ΔG < 0
Таким образом, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном. Увеличение энергии Гиббса
ΔG > 0
свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Если
ΔG = 0
то система находится в состоянии химического равновесия.
Так как энергия Гиббса зависит от энтропии и энтальпии следующим образом:
ΔG= ΔН − TΔS
где Н — энтальпия, S — энтропия, Т — температура, то самопроизвольному протеканию процесса способствуют уменьшение энтальпии и увеличение энтропии системы.
Если энтальпия и энтропия изменяются одновременно, то возможность процесса определяет либо энтальпийный, либо энтропийный фактор.
Д/З запишите в тетрадь примеры решенных задач
Подробнее: http://cyclowiki.org/wiki/%D0%AD%D0%BD%D0%B5%D1%80%D0%B3%D0%B8%D1%8F_%D0%93%D0%B8%D0%B1%D0%B1%D1%81%D0%B0
19.11 11Б Урок проводится в очном режиме.
16.11 11Б класс
Классификация химических реакций в неорганической и органической химии.
Здравствуйте ребята! Сегодня мы начинаем изучение раздела "Химические реакции".
Вспомним классификацию химических реакций в органической химии. Посмотрите видеоурок. Кратко запишите типы классификации химических реакций. Для этого пройдите по ссылке
Для того, чтобы подготовиться к изучении дальнейшего материала в этом разделе, вам нужно вспомнить классификацию химических реакций в неорганической химии. Для повторения вы можете использовать конспекты за 9 класс, ваш учебник п.12 или пройти по ссылке
и послушать объяснение учителя.
Д/з выполнить №3, 9 стр. 58
12.11 11А класс
Химическая связь. Электроотрицательность. Типы химической связи
Добрый день! На сегодняшнем уроке мы начинаем рассматривать вопросы темы "Строение вещества". Начнем с повторения материала по характеристике химической связи.
Предлагаю вам посмотреть видеоурок ссылка
Запишите в тетрадь ответы на вопросы:
1. Что такое химическая связь?
2. Назовите причину и условие образования химической связи.
3. Какие электроны принимают участие в образовании химической связи?
4. Составьте схему классификации химических связей.
5. Запишите механизмы образования всех типов связей, указанных в видеоуроке.
проработайте п. 7
06.11 11Б
Здравствуйте ребята!
Сегодня мы вспомним тему "Причины многообразия веществ: изомерия, гомология, аллотропия, изотопия".
Просмотрите видеофрагмент здесь
Откройте в учебнике п.11. Ответьте письменно на вопрос №1 стр. 51
К следующему уроку выполните индивидуальные задания
(см. документ беседа в ВК)
05. 11 11Б занятие проводится очно. Встречаемся в гимназии
06.11 11А
Здравствуйте ребята!
Тема нашего урока "Валентность и валентные возможности атомов"
Посмотрите внимательно видеофрагмент здесь
Прочтите п.6. Обратите внимание на важную информацию, отмеченную в тексте. Выучите правила
Выполните в рабочих тетрадях №4 стр.31
Д/З Проработать п. 6 Решить №7
02.11 11б
Добрый день ребята!
Закончились ваши удлиненные каникулы, и мы возвращаемся к учебному процессу. Сегодня на уроке я
предлагаю вам вспомнить материал по теме: «Молекулы, химическая связь». Откройте,
пожалуйста, свои конспекты с вопросами данной темы.
Посмотрите видеоурок по данной теме
Повторите пройденный материал.
Для закрепления полученных знаний пройдите тест
1. При
взаимодействии 2,8 г одновалентного металла с водой выделилось 0,2 моль
водорода. Определить металл.
2. Какой
объем водорода выделится при взаимодействии фенола с 5.75г натрия?








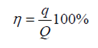

Этот комментарий был удален администратором блога.
ОтветитьУдалить