2022-2023 учебный год
1 семестр
Тема урока: Предмет органической химии
Познакомьтесь с теоретическим материалом:
Нас окружает множество различных веществ. Свойства, строение, происхождение этих веществ различно. Сначала все известные вещества химики поделили на 3 группы: Минеральные, растительные и животные. Изучая эти вещества, шведский химик Берцеллиус пришёл к выводу, что между веществами растительного и животного происхождения нет существенных отличий. Он предложил называть их " органическими", т.к. они содержатся в живых организмах. Так возникла " Органическая химия".
История развития органической химии
Способы получения различных органических веществ были известны еще с древности. Египтяне и римляне использовали красители индиго и ализарин, содержащиеся в растительных веществах. Многие народы знали секреты производства спиртных напитков и уксуса из сахар- и крахмалсодержащего сырья.
Во времена средневековья к этим знаниям ничего не прибавилось, некоторый прогресс начался только в 16-17 в: были получены некоторые продукты, в основном путем перегонки некоторых растительных продуктов. В 1769—1785 г. Шееле выделил несколько органических кислот, таких как яблочная, винная, лимонная, галловая, молочная и щавелевая. В 1773 г. Руэль выделил из человеческой мочи мочевину.
Выделенные из животного или растительного сырья продукты имели между собой много общего, но отличались от неорганических соединений. Так возник термин «Органическая химия» — раздел химии, изучающий вещества, выделенные из организмов (определение Берцелиуса, 1807 г.). При этом полагали, что эти вещества могут быть получены только в живых организмах благодаря «жизненной силе».
Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (NH4OCN).
Важным этапом стала разработка теории валентности Купером и Кекуле в 1857 г., а также теории химического строения Бутлеровым в 1861 г. В основу этих теорий были положены четырёхвалентность углерода и его способность к образованию цепей. В 1865 году Кекуле предложил структурную формулу бензола, что стало одним из важнейших открытий в органической химии. В 1875 г. Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра. В 1917 году Льюис предложил рассматривать химическую связь с помощью электронных пар.
В 1931 г. Хюккель применил квантовую теорию для объяснения свойств ароматических углеродов, чем основал новое направление в органической химии — квантовую химию. В 1933 г. Ингольд провел изучение кинетики реакции замещения у насыщенного атома углерода, что привело к масштабному изучению кинетики большинства органических реакций.
На заре органической химии предметом изучения были преимущественно субстанции биологического происхождения. Именно этому факту органическая химия обязана своим названием. Научно-технический прогресс не стоял на месте, и со временем основной материальной базой органической химии стала каменноугольная смола, выделяемая при получении кокса прокаливанием каменного угля. Именно на основе переработки каменноугольной смолы в конце 19 века возник основной органический синтез. В 50-60 годах прошлого века произошел переход основного органического синтеза на новую базу — нефть.
Предмет органической химии.
Запишите в ваши тетради следующую информацию:
Кекуле (1851 р) определил органическую химию как химию соединений углерода.
Органическая химия -это химия соединений углерода.
Сравнение органических и неорганических веществ
Критерии | Неорганические вещества | Органические вещества |
Элементный состав | Почти все элементы периодической системы Д.И.Менделеева | С, Н, О, N, S, P и другие |
Валентность элементов | Разная, часто переменная | Постоянная: С-ІV, Н-I, О-II, Hal-I |
Виды связи | Все типы: ковалентная, ионная | Ковалентная |
Строение вещества | Атомная, молекулярная, йонная кристаллические решётки | Молекулярные кристаллические решетки |
Термостойкость | Разная: бывают легкоплавкие и тугоплавкие | Легкоплавкие, легко разлагаются |
скорость реакции | Быстро.Часто реакции протекают мгновенно | Обычно медленно, часто реакции проходят в двух направлениях |
Количество | Более 500 тысяч. | Около 40 млн., ежегодно синтезируется 200-300 тыс. новых. |
Для закрепления полученной информации и подготовки к следующему уроку, посмотрите видеофрагмент ССЫЛКА
2021-2022 учебный год
2 семестр
23.05
Тема урока: Обобщение курса органической химии
Здравствуйте ребята. Сегодня завершающий урок за курс 10 класса. Предлагаю вам посмотреть видеофрагмент ССЫЛКА
Для обобщения пройденного материала пройдите тест ССЫЛКА
До встречи в следующем учебном году.
16/05
Тема урока: Искусственные полимеры
Здравствуйте ребята. Запишите тему урока
Посмотрите видеофрагмент по ССЫЛКЕ
Запишите краткую информацию по данной теме.
Выполните письменно задания № 6 стр. 198 и № 2 стр.212
11.04
Тема урока. Аминокислоты. Белки.
Здравствуйте ребята.
Начнем урок с прохождения теста ССЫЛКА. ВНИМАНИЕ! Время для прохождения теста ограничено. Оценки смотрите в электронном журнале.
Запишите в тетради число и тему урока.
Пройдите по ССЫЛКЕ
Запишите ответы на вопросы:
Что такое аминокислоты?
Общая формула аминокислот? Представители.
Номенклатура аминокислот.
В чем суть оптической изомерии?
Физические свойства
Химические свойства (амфотерность, уравнения реакций)
Как образуется пептидная связь?
Что такое белки?
Охарактеризуйте структуру белковой молекулы.
Охарактеризуйте уникальные свойства белков?
Запишите качественные реакции на белки.
Домашнее задание: выучить конспект
04.04 - урок в режиме онлайн.
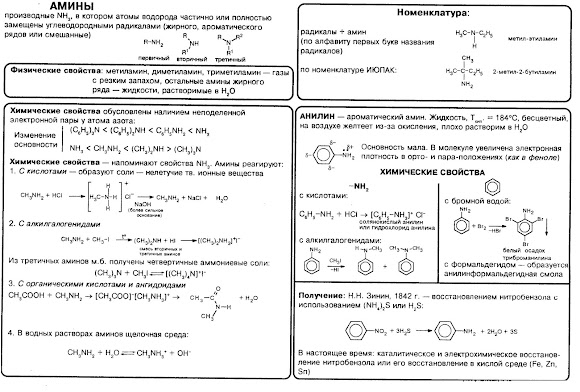
Тема урока: Амины. Анилин.
Видеоурок ССЫЛКА
Опорный конспект
21.03
Тема урока: Решение экспериментальных задач на распознавание органических веществ
Здравствуйте ребята. Сегодня выполняем практическую работу №3. Подготовьте двойные листики в клетку. Они нужны для того, чтобы вы смогли оформить отчет по практической работе и в назначенное время сдать мне на проверку. В ходе работы вы можете использовать ту форму таблицы, которая предложена в видеофрагменте или так писать, как мы делали с вами в классе.
Предлагаю вам посмотреть видеоурок ССЫЛКА
Проанализируйте его содержание. Найдите в учебнике или в конспектах необходимые темы, уравнения качественных реакций. Продумайте, что вы будете писать в таблице. Обратите внимание на то, что уравнения будут занимать много места при записи. Отчет по работе должен соответствовать всем требованиям.
Домашнее задание : написать отчет, повторить тему "Кислородсодержащие органические соединения"
Вопросы задавайте в ВК.
11.02
Тема урока: "Применение уксусной кислоты. Высшие жирные кислоты на примере пальмитиновой и стеариновой ".
Здравствуйте ребята. Запишите число и тему урока. Для проверки домашнего задания пройдите тест по ССЫЛКЕ
Из высших предельных одноосновных карбоновых кислот наиболее важными являются следующие кислоты: СН3(СН2)14СООН – пальмитиновая и СН3(СН2)16СООН – стеариновая. В виде сложных эфиров глицерина они входят в состав растительных и животных жиров.
Характерные особенности пальмитиновой и стеариновой кислот:
1) это твердые вещества белого цвета;
2) эти кислоты не растворимы в воде;
3) углеводородные радикалы в молекулах этих кислот содержат неразветвленную цепь из пятнадцати и семнадцати атомов углерода, которые соединены ?-связими;
4) им свойственны те же реакции, что и другим карбоновым кислотам. Например, при взаимодействии с раствором щелочи они образуют соли: C15H31COOH + NaOH > C15H31COONa + Н2О;
5) натриевые соли пальмитиновых и стеариновых кислот (пальмиаты и стеараты) растворимы в воде;
6) они обладают моющими свойствами и составляют основную часть обычного твердого мыла;
7) из карбоновых солей, которые содержатся в мыле, получаются кислоты, действуя на их водный раствор сильной кислотой, например:
С17Н35СОО- + Na+ + H+ + HSO4- > С17Н35СООН + NaHSO4;
8) кальциевые и магниевые соли высших карбоновых кислот в воде не растворяются
Запишите уравнения по схеме:
C2H6 →C2H4→ C2H5OH→CH3CHO → CH3 – COOH →CH2Cl – COOH
Домашнее задание:
Составьте схему "Применение уксусной кислоты"
1 семестр
08.11 Тема урока: "Полимеризация. Полиэтилен, его свойства и применение. Алкадиены и каучуки. Резина."
Домашнее задание: п.13, написать все возможные изомеры гептена и дать им название
2020-2021 учебный год
2 семестр
Подготовка к контрольной работе
Амины. Анилин.
Видеоурок ССЫЛКА
Опорный конспект
20.02
Тема урока: Глюкоза - вещество с двойственной природой
Здравствуйте ребята. На сегодняшнем уроке мы познакомимся с химическими свойствами глюкозы. Обратите внимание на двойственную природу глюкозы.
Предлагаю вам посмотреть видеоурок ССЫЛКА
Запишите уравнения химических реакций.
Пройдите по следующей ССЫЛКЕ
Запишите уравнения химических реакций.
Домашнее задание: посмотрите видеоопыты ССЫЛКА и ССЫЛКА 2
19.02 Урок проводится в очной форме
08.02
Тема урока: Эфиры, жиры
Для проверки домашнего задания пройдите тест по ССЫЛКЕ
Запишите число и тему урока в рабочей тетради. Посмотрите видеоурок ССЫЛКА
Запишите опорный конспект, используя слайды урока и объяснение учителя
Выучите конспект
25.01
Тема урока: Альдегиды и кетоны
Посмотрите видеоурок ССЫЛКА
Дайте письменную характеристику альдегидов и кетонов, используя материал видеоурока и параграфы 23,24.
Выучите конспект
22.01 Урок проводится в очном
Тема урока: Фенолы
Запишите, используя информацию с видеофрагмента, характеристику фенолов
Выполните письменно задания:
1. Напишите уравнения трех реакций, в результате которых образуется фенол. Укажите условия проведения реакций.
2. Напишите уравнения реакций метилфенола со следующими веществами: а) калием, б) гидроксидом калия, в) бромной водой.
3. Вычислите массу 0,5 моль 2,4,6-трибромфенола.
Домашнее задание:
Рассчитайте массу тринитрофенола, который образуется при взаимодействии фенола с раствором азотной кислоты объемом 300 мл ( массовая доля азотной кислоты 80%, плотность раствора 1,45г/мл.).
1 семестр
21.12 Одноатомные предельные спирты.
Прежде чем перейти к изучению нового материала, пройдите тест ССЫЛКА (отправить сегодня до 20.00)
ПЛАН изучения нового материала
1.Строение молекулы спиртов, определение, общая формула.
2.Гомологический ряд. Изомерия и номенклатура.
3.Получение.
4.Физические свойства.
5.Химические свойства.
6.Применение.
1. Ребята! На первых уроках органической химии, мы четко уяснили, что в состав органических веществ входят С, Н,О,N, даже S и P, галогены и другие химические элементы. Только что изученные вещества – это углеводороды, в их состав входят С и Н. А органические соединения, в состав которых входит кислород, называются кислородсодержащими. К ним относятся спирты, альдегиды, карбоновые кислоты и др. вещества. Сегодня мы с вами начинаем изучать спирты. Их очень много. Но мы начинаем с одноатомных предельных.
Запишите тему урока и первый пункт плана.
Этиловый спирт вы уже знаете.
Экспериментальным путём было установлено, что в состав этилового спирта входят
2 атома углерода, 6 атомов водорода, и 1 атом кислорода. Получается формула С2Н6О.
Согласно теории А.М. Бутлерова этой формуле соответствует две структурные
формулы:
Н Н Н Н
│ │ │ │
Н ─ С ─ С ─ ОН (1) Н ─ С ─ О ─ С ─ Н (2)
│ │ │ │
Н Н Н Н
Какая же из этих формул соответствует
строению этилового спирта? Строение молекул определяет свойства веществ, на
этом основании формула № 1 отвечает строению этилового спирта. В этой формуле
один из водородных атомов связан с атомом кислорода. Связь между ними
ковалентная полярная, если между атомом О и Н. Экспериментально было доказано,
что этиловый спирт реагирует с активными металлами, вытесняя водород. Сколько
атомов водорода вытесняется, это можно доказать опытом. В колбу
с мелкими кусочками натрия приливается по каплям этиловый спирт, выделяющийся
водород вытесняет воду из двугорлой склянки в цилиндр, объём вытесненной воды
соответствует объёму выделившегося водорода. Опытом установлено, что из каждой
молекулы спирта вытесняется только один атом водорода. Формула (№2) не даёт
объяснение такому факту, т.к. атомы водорода равноценны. А №1 отражает особое
положение одного атома Н, который соединён с атомом С через кислород и он менее прочно связан и
вытесняется натрием. Связь О
–Н полярная. Вывод: формула (№1) является структурной формулой этилового спирта
и группа ОН – гидроксогруппа, характерна для спиртов, соединяется с углеводным
радикалом, поэтому молекулярная формула спирта С2Н5ОН или
СН3- СН2-ОН.
Спиртами называются производные у.в. в молекулах которых один или несколько
атомов водорода замещены гидроксогруппами. ОН- это функциональная группа
спиртов, поскольку она обеспечивает характерные свойства спиртов.
Общая формула спиртов. СnH2n+1OH или R-OH
2. метанол СН3ОН метиловый
этанол С2Н5ОН этиловый
пропанол С3Н7ОН пропиловый
бутанол С4Н9ОН бутиловый
пентанол С5Н11ОН амиловый и т. д.
Для спиртов характерны 3 вида изомерии:
1)
изомерия углеродного
скелета
СН3 – СН2 – СН2
– СН2 – ОН С4Н9ОН
СН3 – СН
– СН2 – ОН
бутанол – 1
│
СН3
2 - метилпропанол -1
2)
изомерия положения гидроксогруппы
СН3 – СН2 – СН2
– ОН С3Н7ОН
СН3 – СН
– СН3
пропанол – 1 │ пропанол – 2
ОН
3)
изомерия классов: одноатомные предельные спирты и простые эфиры изомерны
С2Н5ОН СН3
– О – СН3
этиловый
диметиловый
спирт
эфир
3. Спирты могут быть получены синтетическими и биохимическими методами
а)
Синтетические
1) гидролиз галагенопроизводных при
действии водного раствора щёлочи
CH3
– CH2 – Cl
+ NaOH → CH3 – CH2
– OH + NaCl
2)
гидратация этилена
H3PO4,
t, p
C2H4
+ H2O → C2H5OH
3) восстановление альдегидов
О
// Ni
СН3 –
С + Н2 → С2Н5ОН
\
Н
4) метанол получают из водяного газа
t0,
кат.
СО + 2Н2 → СН3 – ОН
б)
Биохимический
Это получение спиртов при брожении
сахаристых веществ в присутствии дрожжей.
С12Н22О11
+ Н2О → 2С6Н12О6
С6Н12О6 → 2С2Н5ОН + 2СО2↑
Спирты получают из картофеля, ячменя и
др. продуктов, получают также из древесных опилок, получается «древесный» или
метиловый спирт, который является ядом. Метиловый спирт используется только в
технических целях.
4. Одноатомные спирты с короткой цепью – жидкости, а
высшие с С12Н25ОН
- твёрдые вещества. С увеличением Mr, пониж. t
кип
По сравнению с соотв. У.В. температура
кипения спиртов выше. Посмотрите, ребята, на таблицу
Температуры
кипения.
|
Предельные углеводороды |
Спирты |
|
метан - 162 этан - 89 пропан - 45 бутан - 5 пентан +36 и т.д. |
метанол 64,7 этанол 78,3 пропанол 97,2 бутанол 117,7 пентанол 137,8 и т.д. |
Повышение температуры объясняется
появлением особого вида связей – водородных. Она образуется как между
молекулами спирта, воды, воды и спирта.
R – O R H – O H R - O H
│ │ │ │ │ │
Н …О – Н Н… О – Н Н…О - Н
Метанол,
этанол, пропанол в воде растворяются в неограниченном количестве. Высшие спирты
в воде не растворимы. Метанол, этанол, пропанол имеют специальный алкогольный
запах, некоторые спирты имеют неприятный запах, высшие спирты запаха не имеют. СН3ОН - ЯД! Небольшая доза, всего один глоток
вызывает отравление, слепоту, паралич, чаще всего – смерть. В годы ВОВ немцы
специально поставляли цистерны с метанолом, солдаты, думая, что это винный
спирт, пили его и потом были тяжёлые последствия.
5. Химические свойства.
1) Спирты реагируют с активными Ме.
2С2Н5ОН + 2Na → 2C2H5ONa + H2↑
этилат нартия
2) Реагирует с галогеноводородными
кислотами
Н2SO4
CH3 –
CH2
– OH + HCl → HCl + CH3
– CH2
– Cl + H2O
Хлорэтан
3) Реакция дегидратации. Д.О.
t, H2SO4
C2H5OH → C2H4↑
+ H2O
4) Образование простых эфиров при
избытке спирта
t=1400C
C2H5OH + HO – C2H5 → C2H5
– O – C2H5 + H2O
диэтиловый эфир
5) Горят на воздухе
С2Н5ОН + 3О2 → 2СО2↑
+ 3Н2О
6) Спирты реагируют с органическими
кислотами с образованием сложных эфиров
О
О
// H2SO4 //
СН3 – С + НО – С2Н5 ↔
СН3 – С + Н2О
\
\
ОН
О - С2Н5
Этилацетат
Это реакция этерификации.
7) Качественная реакция на спирты (все учащиеся).
О
//
С2Н5ОН + Cu → CH3 – C + Cu + H2O
\
H
6. Работа с книгой
д/з записать по плану конспект и выучить характеристику спиртов
18.12 Урок проводится в очном режиме
07.12 Углеводороды. Контрольная работа №1
Здравствуйте ребята.
Сегодня у нас контрольная работа по теме "Углеводороды".
Вопросы к контрольной работе доступны по ссылке. Для тех, у кого не получится открыть документ, я дополнительно прикреплю материалы в электронном журнале. При выполнении работы, будьте внимательны. Варианты соответствуют ряду, на котором вы сидите в классе, считаем от окна. Работы выполняете на двойных листочках в клетку и приносите в школу 08.12 кабинет № 41.
30.11 Тема урока: "Бензол"
Здравствуйте ребята.
Начинаем наш урок с проверки теоретического материала прошлого урока. Перейдите по ССЫЛКЕ и пройдите тест. Тест будет доступен до 16.00 01 декабря
Теперь рассмотрим вопросы новой темы. Послушайте объяснение новой темы в видеоуроке ССЫЛКА
Запишите в рабочей тетради число, тему урока и составьте опорную схему по данному материалу. Вы можете составить ее сами, а можете воспользоваться следующими образцами.
Д/з проработайте п.15,16
23.11
Здравствуйте ребята.
Тема урока Алкины. Реакция полимеризации винилхлорида. Поливинилхлорид и его применение
План урока
Общая характеристика алкинов
Гомологический ряд алкинов
Характеристика тройной связи
Номенклатура
Химические свойства
Посмотрите видеофрагмент №1 ССЫЛКА
Ответьте письменно на вопросы плана № 1-4
Посмотрите видеофрагмент №2 ССЫЛКА
Запишите уравнения реакций, характеризующие химические свойства алкинов. Обратите внимание на качественные реакции алкинов.
Д/з проработайте п. 14, выучите теоретический материал по данной теме
16.11
Тема урока: "Полимеризация. Полиэтилен, его свойства и применение. Алкадиены и каучуки. Резина."
09.11
Тема урока: "Структурная изомерия алкенов"
Повторите материал урока за 28.09
Посмотрите видеоурок по данной теме здесь
Запишите конспект урока, опираясь на рассказ учителя
Для закрепления материала запишите все возможные изомеры пентена и назовите их
02.11.
Тема урока:
Надеюсь, вы
основательно отдохнули за время удлиненных каникул и готовы продолжить
обучение.
Прежде чем приступить к
изучению вопросов темы сегодняшнего урока, я предлагаю вам повторить сейчас
материал уроков за 21 и 28 сентября (рабочие тетради).
Обратите внимание на
гомологический ряд метана, характеристику алканов и номенклатуру.
Теперь мы можем
приступить к изучению новой темы. Чтобы вам было легче разобраться в новом
материале, четко следуйте плану урока и выполняйте все задания последовательно!
1. Внимательно просмотрите видеофрагмент урока по ссылке
3. Пройдите тест по ссылке
Критерии оценивания: 8 правильных ответов оценка 5; 7,6 – 4; 5,4 – 3; 3-1 - 2
Домашнее задание: проработать материал конспекта урока
решить задачу
1 вариант: Углеводород ряда алкенов имеет относительную плотность по кислороду 1,448. Определите молекулярную формулу алкена. Расскажите об особенностях строения его молекулы.
2 вариант: Определите массу хлорэтана, который образуется при взаимодействии 1,12л (н.у.) этена с хлороводородом.



Комментариев нет:
Отправить комментарий